
右图是Na、Cu、Si、H、C、N等元素单质
的熔点高低的顺序,其中c、d均是热和电的良
导体。f的某种同位素常用于考古。
下列判断不正确的是
A. 常温下f和a形成1︰1液态化合物由液体变成气体时克服的是范德华力
B.d单质对应元素原子的电子排布式: 1s22s22p63s23p2
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含2个σ键,2个π键

科目:高中化学 来源: 题型:
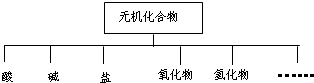 无机化合物可根据其组成和性质进行分类,例如:(如右图所示)
无机化合物可根据其组成和性质进行分类,例如:(如右图所示)| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② HNO3 HNO3 |
③NaOH ④ KOH KOH |
⑤Na2SO4 ⑥ Na2SO3 Na2SO3 |
⑦SO2 ⑧SO3 |
⑨NH3 |
 2SO3
2SO3 2SO3
2SO3
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 。
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示:
该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-=Cu
b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1
查看答案和解析>>
科目:高中化学 来源:2013届浙江省金华一中高三12月月考化学试卷(带解析) 题型:单选题
NA为阿伏加德罗常数,下列叙述正确的是
A.0.5mol雄黄(As4S4,已知As和N同主族,结构如右图)含有NA个S—S键 |
| B.用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属 |
| C.1mol过氧化氢分子中共用电子对数为3NA |
| D.0.1mol Na2CO3·10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省九校联合体高三第二次摸底考试理综化学试卷(解析版) 题型:填空题
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
① 基态Fe3+的M层电子排布式为 。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)

(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是 _。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

① 图中d单质的晶体堆积方式类型是 。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。
查看答案和解析>>
科目:高中化学 来源:2010年江西上高二中、新余钢铁中学高三年级全真模拟(理综)化学部分 题型:填空题
(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 。
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示:
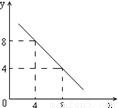
该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-= Cu
b极:Fe-2e-= Fe2+
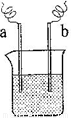
该装置中原电解质溶液一定含有 (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)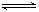 Ba 2+ (aq)+ SO42-(aq) 25℃
时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到
mol·L一1
Ba 2+ (aq)+ SO42-(aq) 25℃
时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到
mol·L一1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com