
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图所示(夹持仪器略去)。主要步骤如下:
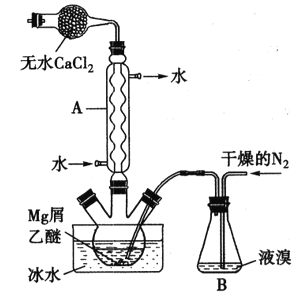
步骤l:三颈瓶中装入10g镁屑和150mL无水乙醚,装置B中加入适量的液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5= MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是___________,它在实验中的作用是____________。
(2)步骡2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是_____________。
(3)步骡3中,第一次过滤得到的固体物质是______;根据步骤3、4,请总结出三乙醚合溴化镁所具有的物理性质:_________。
(4)请根据Mg的性质设计实验证明O2的氧化性比N2的强:________。
(5)将步骤得到的产品在干燥器中冷却到室温后,称量,其质量为61.4g。则该实验制取MgBr2的产率是_____________。
【答案】 球形冷凝管 使挥发出的乙醚和溴蒸气冷却并回流至反应装置 氮气的气流促进了液溴的挥发 反应过于剧烈,使反应过程难以控制 镁屑 可溶于苯等有机溶剂,在0℃时的溶解度较小 将燃着的镁带分别插入O2和N2中,前者燃烧剧烈 80.1%
【解析】Mg+Br2=MgBr2的反应比较剧烈,MgBr2具有很强的吸水性,反应中用盛无水CaCl2的干燥管,防止有水参与,Br2挥发性强,氧化性强,反应中用球形冷凝管不断冷凝,让它与Mg 充分接触
(1). 球形冷凝管,它在实验中的作用是使挥发出的乙醚和溴蒸气冷却并回流至反应装置;(2)液溴具有挥发性,干燥的氮气流促进液溴不断地挥发,慢慢进入三颈瓶中与镁反应,如果将所用液溴一次性全部加入三颈瓶中,镁与溴反应过于激烈,放出大量热,反应难以控制;(3)步骡3中,第一次过滤得到的固体物质是末反应的镁,三乙醚合溴化镁所具有的物理性质:可溶于苯等有机溶剂,在0℃时的溶解度较小。(4)氧气的氧化性比氮气强,故将燃着的镁带分别插入O2和N2中,前者燃烧剧烈,从而证明氧气的氧化性强;(5)10克镁理论上可得到的MgBr2为:![]() ,实际生成的MgBr2为61.4gMgBr2,MgBr2的产率为
,实际生成的MgBr2为61.4gMgBr2,MgBr2的产率为![]() 。管凝衣强,氧化性强,气体
。管凝衣强,氧化性强,气体


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】硫、碳、氮等是重要的非金属元素。请回答下列有关问题:
(1)H2S广泛存在于化石燃料中,因此H2S的吸收和利用是化石燃料化工中的一项重要任务。
①H2S可用NaClO溶液吸收,吸收后的溶液既能使AgNO3溶液生成白色沉淀,也能使Ba(NO3)2 溶液生成白色沉淀,则H2S用过量NaClO溶液吸收的离子方程式为_______________________。
②利用多硫化物(如Na2Sx)吸收H2S,其吸收原理可用以下四步反应表示:
ⅰ.H2S+OH-=HS-+H2O; ⅱ.2HS-![]() H2↑+S22-;
H2↑+S22-;
ⅲ.H2S+S22-=2HS-+S↓; ⅳ.HS-+H2O=H2S+OH-。
四步反应的总反应中的生成物是_______,在总反应中,多硫化物的作用是_____________。
(2)25℃时,H2CO3、NH3H2O在水中的电离平衡常数如下表:
弱电解质 | H2CO3 | NH3H2O |
电离常数 | Ka1=4.0×l0-7 Ka2=5.0×l0-11 | Kb=2.0×10-5 |
①判断0.1 molL-1的(NH4)2CO3溶液呈_______性(填“酸”“中”或“碱”),该溶液中c(CO32-)、c(HCO3-)、c(NH4+)的浓度由大到小的顺序为______________。
②0.50 mol L-1的Na2CO3溶液的pH=_______(忽略CO32-第二步水解和H2O的电离)。
③25℃时,Mg(OH)2的Ksp=2.0×10-11,要使0.002 molL-1的MgSO4溶液中生成Mg(OH)2沉淀,应调整溶液pH不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种兴奋剂的结构简式如图: 下列有关该物质的说法正确的是( )。
下列有关该物质的说法正确的是( )。
A. 该分子中所有碳原子可以稳定的共存在一个平面中
B. 1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol
C. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D. 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①若上述溶液中再加入等体积水后,所得溶液的质量分数大于0.5w
②c=![]()
③w=![]() ×100%
×100%
④若上述溶液中再加入0.5V mL同浓度稀盐酸,充分反应后,溶液中离子浓度大小关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+)
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)═B(g)+C(g),若反应物的浓度由2molL﹣1降到0.8molL﹣1需要20s,那么反应物浓度再由0.8molL﹣1降到0.2molL﹣1所需要的时间为( )
A. 10 s B. 大于10 s C. 小于10 s D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下,反应 X(g)+3Y(g![]() 2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是
2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是

A. 图中a、b两点对应的平衡常数相等
B. 上述反应在达到平衡后,缩小体积,Y的转化率提高
C. 升高温度,正、逆反应速率增大,平衡向正反应方向移动
D. 将2.0molX、6.0molY,置于密闭容器中发生反应,放出的热量为2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①需要加热方能发生的反应一定是吸热反应
②化学反应的发生一定会伴随能量变化
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
④旧化学键的断裂说明-一定发生了化学反应
A. ③④ B. ①② C. ②③ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com