
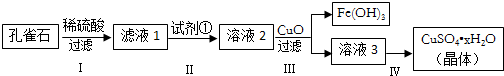
���� ��ȸʯ����Ҫ�ɷ�ΪCu2��OH��2CO3����������FeCO3��Si�Ļ��������ϡ���ᷴӦ�����ɶ�����̼���壬���˵õ�����������壬�õ���Һ1Ϊ����ͭ������������Һ�������ӡ�ʱ��ͨ�������������⽫Fe2+������Fe3+���õ���Һ2Ϊ����ͭ����������Һ���ټ���CuO���������ҺpH���������������������������������˵õ���ҺΪ����ͭ��Һ����Һ3Ϊ����ͭ��Һ��ͨ������Ũ������ȴ�ᾧ������ϴ�ӵõ�����ͭ���壻
��1��������м����Լ��ٵ�Ŀ����������������Ϊ�����ӣ����ڳ�ȥ�������Լ��ܺ��������ӷ�Ӧ�Ҳ��������µ����ʣ�
��2����Һ�еõ����ʵķ���������Ũ������ȴ�ᾧ������ϴ�ӣ�
��3��NaClO��Fe��OH��3��ǿ���������·�Ӧ�Ƶ�K2FeO4��FeԪ�صĻ��ϼ����ߣ���ClԪ�صĻ��ϼ۽��ͣ���ϵ��ӡ�����غ����ڼ���п����У�п����������������Ӧ��K2FeO4������������ԭ��Ӧ�������������ݴ���д�缫��Ӧʽ��ע��������ҺΪ������Һ��
��4����������CuOĿ���ǵ�����Һ��pHʹ�����ӳ�����ȫ��ͬʱͭ���Ӳ����������ݳ�����Fe��OH��3��Cu��OH��2���ܶȻ�����������Һ�е�������Ũ�ȣ��ݴ��ж�pH��Χ��
��5��������ĩ������Ϊ1.6gΪ����ͭ����������ǰ�������仯Ϊ�ᾧˮ����������ϻ�ѧ����ʽCuSO4•xH2O$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+xH2O����x��
��� �⣺��ȸʯ����Ҫ�ɷ�ΪCu2��OH��2CO3����������FeCO3��Si�Ļ��������ϡ���ᷴӦ�����ɶ�����̼���壬���˵õ�����������壬�õ���Һ1Ϊ����ͭ������������Һ�������ӡ�ʱ��ͨ�������������⽫Fe2+������Fe3+���õ���Һ2Ϊ����ͭ����������Һ���ټ���CuO���������ҺpH���������������������������������˵õ���ҺΪ����ͭ��Һ����Һ3Ϊ����ͭ��Һ��ͨ������Ũ������ȴ�ᾧ������ϴ�ӵõ�����ͭ���壻
��1��������м����Լ��ٵ�Ŀ����������������Ϊ�����ӣ����ڳ�����ȥ�������Լ��ܺ��������ӷ�Ӧ�Ҳ��������µ����ʣ�
a��KMnO4��Һ������������������ӣ�������������ӡ������ӣ���a�����ϣ���������
b������H2O2��������������Ϊ�����ӣ��������ⱻ��ԭΪˮ�����������ʣ���b���ϣ�
c��Fe�۲��������������ӣ���c�����ϣ�
d������KSCN��Һ����������γ��������������������ӣ��������ӵĴ��ڻ��������ͭ�������������d�����ϣ�
�ʴ�Ϊ��b��
��2������������Һ�еõ����ʵķ���������Ũ������ȴ�ᾧ������ϴ�ӣ�
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��3��NaClO��Fe��OH��3��ǿ���������·�Ӧ�Ƶ�K2FeO4��FeԪ�صĻ��ϼ����ߣ���ClԪ�صĻ��ϼ۽��ͣ��ɵ��ӡ�����غ��֪���ӷ�ӦΪ2Fe��OH��3+3C1O-+4OH-=2FeO42-+3C1-+5H2O���ڼ���п����У�п����������������Ӧ��K2FeO4������������ԭ��Ӧ�����������������ĵ缫��ӦʽΪ2FeO42��+6e��+5H2O=Fe2O3+10OH����
�ʴ�Ϊ��2Fe��OH��3+3C1O-+4OH-=2FeO42-+3C1-+5H2O��2FeO42��+6e��+5H2O=Fe2O3+10OH����
��4��Cu��OH��2���ܶȻ�Ksp=3.0��10-20����Һ��CuSO4��Ũ��Ϊ3.0mol•L-1��c��Cu2+��=3.0mol•L-1�������ܶȻ�����c��Cu2+����c2��OH-��=3.0��10-20��c2��OH-��=$\frac{3.0��10{\;}^{-20}}{3.0}$=10-20���õ�c��OH-��=10-10mol/L������ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14�����c��H+��=10-4mol/L����ҺpH=4����Cu��OH��2��ʼ����ʱ��Һ��pHΪ4����������Һ�е�����Ũ��С��1��10-5 mol•L-1ʱ����Ϊ������ȫ��Fe��OH��3���ܶȻ�Ksp=8.0��10-38��c��Fe3+����c3��OH-��=8.0��10-38��c3��OH-��=$\frac{8.0��10{\;}^{-38}}{1��10{\;}^{-5}}$=8.0��10-33�����c��OH-��=2��10-11mol/L��ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=5��10-4mol/L����pH=3.3������Ҫ��ȥFe3+������ʧCu2+��Һ��pH��Χ��3.3��pH��4��
�ʴ�Ϊ��3.3��pH��4��
��5����ȡ2.4g����ͭ���壬�������������ٸı�ʱ��������ĩ������Ϊ1.6gΪ����ͭ������n��CuSO4�����ʵ���=$\frac{1.6g}{160g/mol}$=0.01mol��������������2.4g-1.6g=0.8g��ˮ�����ʵ���=$\frac{0.8g}{18g/mol}$=0.044mol��
CuSO4•xH2O$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+xH2O
1 x
0.01mol 0.044mol
x=4.4
�ʴ�Ϊ��4.4��
���� ���⿼�������ʷ��뷽�����ᴿ��Ӧ�ã��漰�������ʵ�����Ӧ�á��绯ѧ֪ʶ����ҺpHֵ�ļ���ȣ��ۺ���ǿ������ʵ��������������̷����ǹؼ�����Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������պ���ʱҪ���������н��� | |
| B�� | ����ʱ��ˮ���������ϲ�ͨ�룬���²����� | |
| C�� | ��ij��Һ�м���AgNO3��Һ�����ɰ�ɫ����������Һһ������Cl- | |
| D�� | ��Һʱ��������Ȼ�̼��Һ�ӷ�Һ©���¿ڷų���ˮ����Ͽڵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
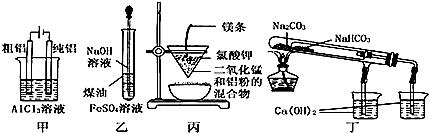
| A�� | �ü�ͼװ�õ�⾫���� | |
| B�� | ����ͼװ���Ʊ� Fe��OH��2 | |
| C�� | �ñ�ͼװ�ÿ��Ƶý����� | |
| D�� | �ö�ͼװ����֤ NaHCO3 �� Na2CO3�����ȶ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȣ��棩 | 0 | 20 | 60 |
| K2SO4�ܽ������g�� | 7.4 | 11.1 | 18.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ�ԣ�X-��Y- | |
| B�� | ��X-��Y-��Z-��W- �� Z- �Ļ�ԭ����ǿ | |
| C�� | �����ԣ�Z2��W2 | |
| D�� | ��Ӧ2Z-+Y2=2Y-+Z2���Է��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ڢۢ� | B�� | �����٢ۢ� | C�� | ����ʢڢ� | D�� | �ǵ���ʢܢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com