
 ��
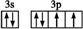
������ ��ԭ��������С�����A��B��C��D��E����Ԫ�ع���ij��λ������X����ԭ�Ӹ�����Ϊ14��4��5��1��1������C��DԪ��ͬ������ԭ������DΪC�Ķ�������CΪOԪ�ء�DΪSԪ�أ�EԪ�ص���Χ�����Ų�Ϊ��n-l��dn+6ns1����n+6=10����n=4��������Χ�����Ų�Ϊ3d104s1����EΪCu�����ԭ��������֪AΪH��BΪN����ԭ����Ŀ֮�ȣ���֪������ﺬ��1���ᾧˮ����X�Ļ�ѧʽΪ��[Cu��NH3��4]SO4•H2O���Դ˽����⣮
��� �⣺��1��������������֪�������X�Ļ�ѧʽΪ��[Cu��NH3��4]SO4•H2O��
�ʴ�Ϊ��[Cu��NH3��4]SO4•H2O��
��2��ͬ�������϶��µ�һ�����ܼ�С����OԪ�ص�һ�����ܴ���SԪ�أ�O��NԪ��ͬ���ڣ�NԪ��ԭ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܴ���OԪ�أ��ʵ�һ��������С���������˳��Ϊ��S��O��N���ʴ�Ϊ��S��O��N��
��3��DΪSԪ�أ�ԭ�ӵ��������ӹ����ʾʽΪ  ��
��
�ʴ�Ϊ�� ��
�� ��
��
��4��OԪ�ؿ���HԪ���γ����ֳ����Ļ������ԭ�Ӹ����ȷֱ�Ϊ1��1��l��2����ΪH2O��H2O2�����ֻ����������Ȼ��ܣ�����Ҫԭ��Ϊ��H2O��H2O2����֮����������
�ʴ�Ϊ��H2O��H2O2֮���γ������
��5��HԪ����CuԪ�ؿ��γ�һ�ֺ�ɫ���ӻ�����Y����ԭ�Ӹ�����Ϊ1��1����YΪCuH��CuH��ϡ���ᷴӦ������һ����ɫ��Һ��������ɫ���壨����һ��ΪAԪ�صĵ��ʣ��������ΪCu��NO3��2��������ϡ����Ļ�ԭ����NO����Ӧ��ѧ����ʽ��6CuH+16HNO3=6Cu��NO3��2+3H2��+4NO��+8H2O��
�ʴ�Ϊ��6CuH+16HNO3=6Cu��NO3��2+3H2��+4NO��+8H2O��
���� ���⿼�����ʽṹ�����ʣ�Ϊ�߿��������ͣ��漰Ԫ�ػ������ƶϡ������ܡ���������Ų���������ӻ���ʽ����ѧ���ȣ��ؼ��Ǹ�����λ��������ɽ����ƶϣ���Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
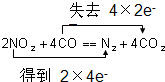
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��Na+��Cl-��NO3- | B�� | Al3+��Na+��NO3-��Cl- | ||
| C�� | K+��Na+��Cl-��AlO2- | D�� | K+��NH4+��SO42-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢۢ� | C�� | �٢� | D�� | �٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£�
��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���������Ӽ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ
���������Ӽ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ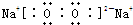 �����м��Թ��ۼ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ
�����м��Թ��ۼ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
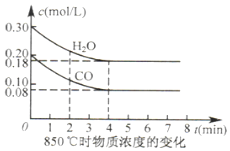 ����β�����������������ԭ��֮һ��
����β�����������������ԭ��֮һ��| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com