
| A、①③⑤ | B、②④ |
| C、①③④⑤ | D、①②③④⑤ |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
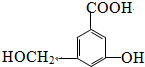
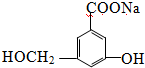
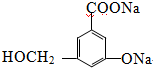
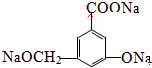 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
| B、能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- |
| C、c(H+):c(OH-)=1:1012的水溶液中:CO32-、Na+、NO3-、AlO2- |
| D、无色溶液中:K+、Na+、MnO4-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
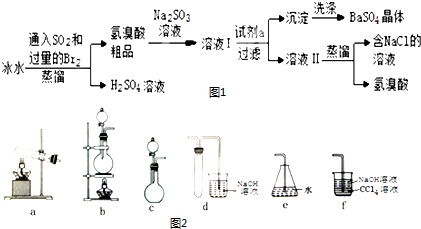
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前滴定管中有气泡,滴定后消失 |
| B、碱式滴定管量取NaOH溶液时,未进行润洗操作 |
| C、滴定时达到滴定终点时俯视读数 |
| D、锥形瓶取用NaOH待测液前加少量水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com