
| | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 | 证明稀释前c(X)=10c(Y) |
| D | 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 | 证明非金属性Cl>F |


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源:不详 题型:单选题
| A.Na+、SO32-、I- | B.Na+、Br-、CO32- |
| C.Fe2+、I-、SO32- | D.Fe2+、CO32-、Br- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H+、I-、NO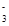 、SiO32- 、SiO32- | B.NH4+、OH-、Cl-、HCO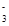 |
C.K+、SO42-、Cu2+、NO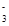 | D.Al3+、Mg2+、SO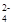 、CO 、CO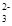 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知某温度下纯水中的c(H+)=2×l0-7mol.L-1,据此无法求出水中c(OH-) |
| B.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2 |
C.常温下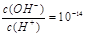 的溶液中存在Al3+、NH4+、Cl-、NO3- 的溶液中存在Al3+、NH4+、Cl-、NO3- |
| D.已知: |
| 共价键 | C—C | C=C | C—H | H—H |
| 键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
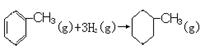 的焓变
的焓变查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、ClO- |
| B.通入过量SO2气体后的溶液中:K+、Na+、CO32-、SO42- |
| C.AlO2一 的浓度为0.1 mol/L的溶液中:K+、Na+、SiO32-、SO42- |
| D.常温下,由水电离出的c(H+)=1×10-11 mol/L的溶液中:Fe3+、Br—、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/LNaHSO4溶液中: K+ NH4+ HCO3— NO3— |
| B.与铝反应产生氢气的溶液中:Na+ NH4+ SO42—、 CH3COO— |
| C.滴加酚酞显红色的溶液中: Na+ NO3— SO42— CO32— |
| D.NaNO3溶液中: Fe2+ H+ Cl— I— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH4+):③ > ② |
| B.pH:① > ② > ③ |
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动 Mg2+ (aq) + 2OH- (aq)向溶解方向移动 |
| D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴加氨水的过程中,水的电离平衡将正向移动 |
| B.滴加b L氨水后的溶液中,n(NH4+) = 200 n(NH3·H2O) = 1 mol |
| C.所滴加氨水的浓度为0.005 / b mol·L-1 |
| D.滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+) = c(NO3-) > c(H+) = c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com