
 2SO3(g)������д���пհף�
2SO3(g)������д���пհף� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
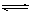 cC(g)����ƽ�������������ϵ��ѹǿ(�¶Ȳ���)���±��г��˲�ͬѹǿ�·�Ӧ����ƽ��ʱ����A��Ũ�ȣ�
cC(g)����ƽ�������������ϵ��ѹǿ(�¶Ȳ���)���±��г��˲�ͬѹǿ�·�Ӧ����ƽ��ʱ����A��Ũ�ȣ�| ѹǿ(Pa) | 2��105 | 4��105 | 8��105 |
| A��Ũ��(mol/L) | 0.085 | 0.15 | 0.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
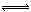 CO2��g����H2��g����K��1��850��ʱ�������ݻ�Ϊ2L���ܱ�������ͬʱ����1.0mol CO��3.0mol H2O��1.0mol CO2��xmol H2��
CO2��g����H2��g����K��1��850��ʱ�������ݻ�Ϊ2L���ܱ�������ͬʱ����1.0mol CO��3.0mol H2O��1.0mol CO2��xmol H2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H < 0
CH3OH(g) ��H < 0| A��v��(H2)��2 v��(CH3OH) | B��v��(H2)��v��(CO) |
| C��������ѹǿ���ֲ��� | D�����������ܶȲ��� |
 Ũ��Ϊ0.6mol/L��������¶��µĻ�ѧƽ�ⳣ����
Ũ��Ϊ0.6mol/L��������¶��µĻ�ѧƽ�ⳣ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �����������ڴ��������е�
�����������ڴ��������е� �����������
����������� �Ļ�ѧ��ӦΪ��
�Ļ�ѧ��ӦΪ�� 2N2��g����3H2O��g��
2N2��g����3H2O��g�� 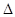 H<0
H<0| A����λʱ��������NO��N2�����ʵ�����Ϊ1��2ʱ����Ӧ�ﵽƽ�� |
| B��ƽ��ʱ�������������䣬����NH3��Ũ�ȣ������е��������ת���ʼ�С |
| C��ƽ��ʱ�������������䣬�����¶ȿ�ʹ�÷�Ӧ��ƽ�ⳣ������ |
| D�������������䣬ʹ�ø�Ч�����������е��������ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
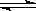 O2(g)+ 2NO(g)����H��0���ﵽ
O2(g)+ 2NO(g)����H��0���ﵽ ƽ�⡣���ı�����һ������X��Y��X�ı仯����ͼ�����ߵ���
ƽ�⡣���ı�����һ������X��Y��X�ı仯����ͼ�����ߵ���
| A����X��ʾ�¶�ʱ��Y��ʾNO�����ʵ��� |
| B����X��ʾѹǿʱ��Y��ʾNO2��ת���� |
| C����X��ʾ��Ӧʱ��ʱ��Y��ʾ���������ܶ� |
| D����X��ʾNO2�����ʵ���ʱ��Y��ʾO2�����ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)+qD (g) DH <0�������жϣ�������ȷ���� �� ��
pC(g)+qD (g) DH <0�������жϣ�������ȷ���� �� �� 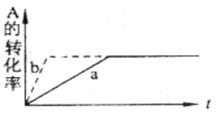
 �������1������ʱA��Ũ�ȱ�Ϊԭ����0��6������m+n<q+p
�������1������ʱA��Ũ�ȱ�Ϊԭ����0��6������m+n<q+p�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(��)��6��ʱ��ϵ�ﵽƽ�⣬��ʱ��������������ʵ���Ϊ��ʼʱ��0.6������1��H2�ķ�Ӧ���� ��
CH3OH(��)��6��ʱ��ϵ�ﵽƽ�⣬��ʱ��������������ʵ���Ϊ��ʼʱ��0.6������1��H2�ķ�Ӧ���� �� 2 H2(��) + CO(��)��ƽ�ⳣ��K
2 H2(��) + CO(��)��ƽ�ⳣ��K �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ����һ��ʱ����Ӧ2NO(g)��O2(g)
����һ��ʱ����Ӧ2NO(g)��O2(g)  2NO2(g) ��H<0��NO��ת�������¶ȱ仯��ϵ����ͼ��ͼ����a��b��c��d�ĸ��㣬���б�ʾδ�ﵽƽ��״̬����v��<v���ĵ���
2NO2(g) ��H<0��NO��ת�������¶ȱ仯��ϵ����ͼ��ͼ����a��b��c��d�ĸ��㣬���б�ʾδ�ﵽƽ��״̬����v��<v���ĵ���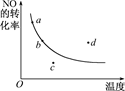
| A��a | B��b | C��c | D��d |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com