
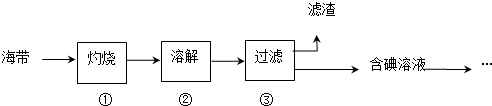
| 实验步骤 | 预期现象与结论 |
| 步骤1:取食盐样品约2g置于表面皿中,滴入3滴淀粉溶液 | 若显蓝色,则假设1成立.若不显蓝色,则进行步骤2 |
| 步骤2: | |
| 步骤3: | |
| … |
| 实验步骤 | 预期现象与结论 |
| 步骤2:取食盐样品2g置于表面皿中,滴入几滴1.0mol/LCH3COOH溶液和3-4滴3%H2O2后,滴入3滴淀粉溶液 | 若溶液显蓝色,假设2成立,若不显蓝色,则进行步骤3. |
| 步骤3:取食盐样品2g置于表面皿中,滴入几滴NaHSO3溶液,再滴入3滴淀粉溶液 | 若溶液显蓝色,则假设3成立;若不显蓝色结合步骤2、3中未见蓝色溶液的现象可判断该食盐样品不含碘. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、NH2D?H2O和D3O+ |
| B、NH3?D2O和HD2O+ |
| C、NH3?HDO和D3O+ |
| D、NH2D?HDO和H2DO+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
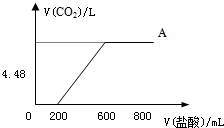
查看答案和解析>>
科目:高中化学 来源: 题型:
 溴被称为“海洋元素”.已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素”.已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.实验室模拟从海水中提取溴的主要步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | T1 | 573 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |

| ||
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | △H1 |
| CO(g) | △H2 |
| CH4(g) | △H3 |
| ||
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com