
 右图所表示在密闭容器中反应:2SO2(g)+O2(g)
右图所表示在密闭容器中反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是 ;b ~c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
2SO3(g) ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是 ;b ~c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
(I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(II)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的体积分数为 。
查看答案和解析>>
科目:高中化学 来源:2010年山西省汾阳中学高二上学期第二次月考(化学) 题型:填空题
(6分)右图所表示在密闭容器中反应:2SO2(g)+O2(g) 2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是 ;b ~c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处.
2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是 ;b ~c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处. 
查看答案和解析>>
科目:高中化学 来源:2011届浙江省嘉兴一中高三高考模拟试题(理综)化学部分 题型:单选题
(I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a. 6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)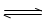 CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |
 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol

查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三高考模拟试题(理综)化学部分 题型:选择题
(I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:

以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(II)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。


图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的体积分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com