
| A. | 任何氧化还原反应原则上都可以设计成原电池 | |
| B. | 原电池中电子从负极经导线流入正极 | |
| C. | 原电池中正极得电子数与负极失电子数一定相等 | |
| D. | 铜-锌-稀硫酸组成的原电池,电解质溶液中H+向负极移动 |
科目:高中化学 来源: 题型:填空题
 和
和 ⑤H2O和H2O2
⑤H2O和H2O2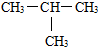 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
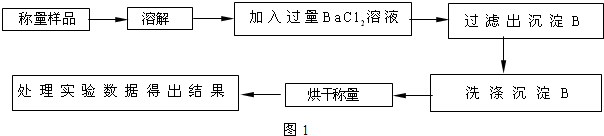
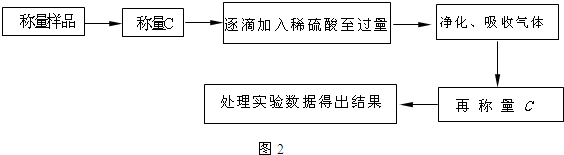
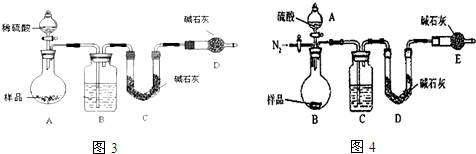
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
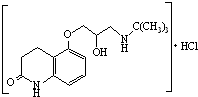 )可用于治疗心绞痛和青光眼.
)可用于治疗心绞痛和青光眼.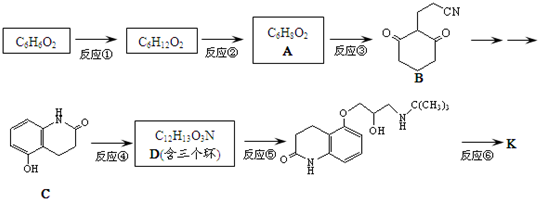
 D
D
 、
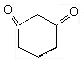
、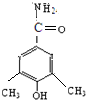
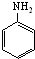 )与HNO2和H3PO2反应可得苯.请设计从C合成
)与HNO2和H3PO2反应可得苯.请设计从C合成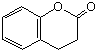 的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应都是吸热反应 | |
| B. | 化学反应都是放热反应 | |
| C. | 物质发生化学反应都伴随着能量变化 | |
| D. | 有能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
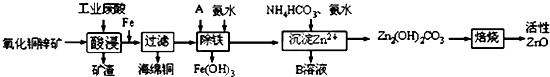
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -870.3KJ•mol-1 | B. | -571.6KJ•mol-1 | C. | +787.0KJ•mol-1 | D. | -488.3KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在实验室中将工业酒精转化为无水酒精的方法是:加入过量的生石灰后分液 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 用重结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| D. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com