
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 导电能力:c>a | |
| D. | 图象中a点酸的总浓度小于b点酸的总浓度 |
分析 A.由表格数据可知,CH3COOH的酸性大于HClO的酸性;
B.由Ka可知,HClO的酸性大于HCO3-的酸性;
C.弱酸溶液的pH越大,氢离子浓度越小,而离子浓度越大、导电性越强;
D.图中a、b相比较,开始pH相同,稀释相同倍数后a点pH大.
解答 解:A.由表格数据可知,CH3COOH的酸性大于HClO的酸性,酸性越弱,对应盐的水解程度越大,则相同浓度的CH3COONa溶液的碱性小于NaClO溶液,故A错误;
B.由Ka可知,HClO的酸性大于HCO3-的酸性,则NaClO溶液中通入少量二氧化碳的离子方程式为ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C.弱酸溶液的pH越大,氢离子浓度越小,而离子浓度越大、导电性越强,则导电能力:a>c,故C错误;
D.图中a、b相比较,I、II的开始pH相同,稀释相同倍数后,则I的酸性大于II的酸性,a点离子浓度小,则a点酸的总浓度小于b点酸的总浓度,故D正确;
故选D.
点评 本题考查弱电解质的电离,为高频考点,把握表格数据及图象的应用、弱酸电离平衡移动、盐类水解、pH稀释为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
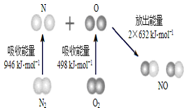 根据如图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )
根据如图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )| A. | N2(g) 与O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 mol O原子结合生成O2(g)时需要吸收498 kJ能量 | |
| C. | 1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量 | |
| D. | 该反应中反应物总能量高于生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯有二种不同结构 | |
| B. | 高温下甲烷能分解 | |
| C. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| D. | 等质量的聚乙烯、乙烯分别充分燃烧,聚乙烯所耗氧气的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
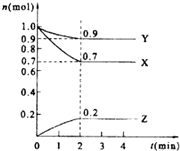 某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入碘化钾溶液后用汽油萃取 | |
| B. | 乙酸乙酯中混有乙酸,加入 NaO H 溶液加热后用分液漏斗分液 | |
| C. | 乙烷中混有乙烯,通过盛有酸性 KMnO4 溶液的洗气瓶洗气 | |
| D. | 乙醇中混有水,加入生石灰,再加热蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泡沫灭火器内分别装有硫酸铝、碳酸钠溶液以及发泡剂 | |
| B. | 明巩既可用做净水剂,也可用作消毒剂 | |
| C. | PM2.5是指直径大于2.5微米的颗粒污染物 | |
| D. | 维生素C具有还原性,可用作食品抗氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com