

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
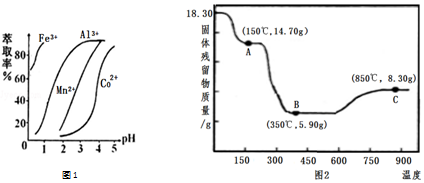
分析 含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴;
(1)Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水;
(3)根据草酸的二级电离大于氨水的电离常数以及盐类水解的规律分析;
(4)为晶体表面的附着液,需要对晶体进行洗涤,洗涤时不能再引入新的杂质离子,据此分析判断;
(5)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重;
(6)由图可知,C点钴氧化物质量为8.30g,氧化物中氧元素质量为8.30g-5.9g=2.40g,据此求算氧化物中Co原子与O原子物质的量之比,确定Co的氧化物化学式.
解答 解:含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴.
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,
故答案为:将Co3+、Fe3+还原为Co2+、Fe2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)盐类水解,谁强显谁性,NH3•H2O?NH4++OH- Kb=1.8×10-5,HCO4-?H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(4)为洗涤晶体附着的离子,同时不引入新的杂质离子,过滤获得晶体洗涤时,可直接选用蒸馏水洗涤,故答案为:A.
(5)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳,
故答案为:除去溶液中的Mn2+;B;
(6)由图可知,C点钴氧化物质量为8.30g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.30g-5.9g=2.40g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.40}{16g/mol}$≈2:3,故C的Co氧化物为Co2O3,
故答案为:Co2O3.
点评 本题考查物质分离和提纯,为高频考点,涉及溶度积常数计算、沉淀与pH的关系、盐类水解等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
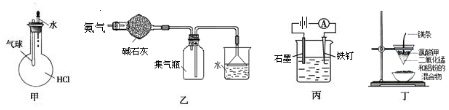
| A. | 如图装置甲:验证HCl气体在水中的溶解度大 | |
| B. | 如图装置乙:可干燥、收集氨气,并吸收多余的氨 | |
| C. | 如图装置丙:防止铁钉生锈 | |
| D. | 如图装置:可制得金属锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
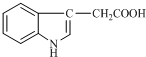 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸的分子式是C10H10NO2 | |
| B. | 吲哚乙酸苯环上的二氯代物共有四种(不考虑立体异构) | |
| C. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 | |
| D. | 1 mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用植物秸秆可以生产香料乙酸乙酯 | |
| B. | 从煤焦油中提取苯和苯的同系物,可采取的方法是萃取 | |
| C. | 用石油裂解产物通过加聚反应直接制备PVC(聚氯乙烯) | |
| D. | 油脂在氢氧化钠溶液中加热发生皂化反应,最终生成高级脂肪酸和丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 常温下将Cu放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| C | 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 |
| D | 向浓度均为0.1mol•L-1的Al2(SO4)3、Fe2(SO4)3的溶液中逐滴加入氨水 | 先有红褐色沉淀生成,后有白色沉淀生成 | Al(OH)3 的溶度积比Fe(OH)3的大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe(OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加入H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气主要含乙烯、丙烯和甲烷 | |
| B. | 航空煤油中存在烷烃的同系物 | |
| C. | 相同碳原子数的醇与卤代烃比较,醇在水中溶解度更大 | |
| D. | 聚乙烯和聚甲荃丙烯酸甲酯都是通过加聚反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、Fe3+、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-3mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 溶有NaHSO4的溶液中:K+、SO42-、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com