
【题目】(加试题)NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。某兴趣小组同学用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验,步骤如下:
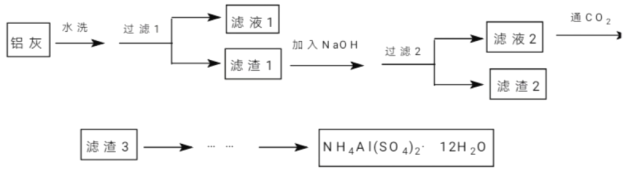
(1)下列有关说法中正确的是_________。
A.“滤液1”中含有K+、Mg2+、Cl-
B.“滤渣1”和“滤渣2”中含有相同的物质
C.“过滤1”可用倾析法,以缩减实验时间
D.将“滤液3”蒸干并灼烧,可得纯碱
(2)用NaOH溶解“滤渣1”时,可以采用_________的方式提高浸出率(写出3条)。
(3)向“滤液2”中通入足量的CO2,写出相应的离子反应方程式__________________。
(4)由“滤渣3”制备铵明矾,经过如下步骤:a→g→_________→h(依次填入正确的序号)
a.加硫酸溶解 b.抽滤
c.加入蒸发皿中
d.降温结晶
e.蒸发至表面出现晶膜
f.配制饱和硫酸铵溶液
g.将硫酸铝溶液转移至蒸发皿
h.洗涤、干燥
(5)①根据各物质的溶解度曲线(见下图),在80℃时,用一定浓度的硫酸溶解“滤渣3”时,最适宜的硫酸浓度为_________。

A.3mol/L(1.20g/mL)
B.6mol/L(1.34g/mL)
C.9mol/L(1.49 g/mL)
D.18mol/L (1.84g/mL)
②所需硫酸用量的简便确定方法是__________________。
【答案】BD 加热、提高NaOH浓度、搅拌等 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- OH-+CO2=HCO3- f→c→e→d→b A 逐滴加入(3 mo1·L-1)硫酸,并不断搅拌,至沉淀恰好完全溶解
【解析】
铝灰水洗的目的是洗去表面的氯酸钾杂质,所以滤液1主要含有KClO3,滤渣1主要含有氧化铁、铝粉、镁条,加入NaOH溶液,Al与NaOH溶液反应生成偏铝酸钠,故滤液2中主要含有偏铝酸钠和氢氧化钠,滤渣2中主要含有氧化铁、镁条,向滤液2中通入CO2气体,偏铝酸钠与CO2反应生成氢氧化铝,故滤渣3为氢氧化铝,得到的氢氧化铝再制备NH4Al(SO4)2·12H2O(铵明矾),据此答题。
(1)A.“滤液1”中主要含有氯酸钾,故含有K+、ClO3-,故A错误;
B.“滤渣1”中含有氧化铁、铝粉、镁条,“滤渣2”中含有氧化铁、镁条,含有相同的物质为氧化铁、镁条,故B正确;
C.倾析法可以将颗粒较大的固体与溶液分离,滤渣1中含有铝粉,颗粒较小,不能使用倾析法,故C错误;
D.“滤液3”中主要含有碳酸氢钠,碳酸氢钠蒸干并灼烧,受热分解生成纯碱,故D正确。
故答案为:BD。
(2)用NaOH溶解“滤渣1”时,可采用加热、提高NaOH浓度、搅拌等方式提高浸出率,故答案为:加热、提高NaOH浓度、搅拌等。
(3)向“滤液2”中通入足量的CO2,偏铝酸钠与CO2反应生成氢氧化铝和碳酸氢钠,氢氧化钠与足量的CO2反应生成碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- OH-+CO2=HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- OH-+CO2=HCO3-。
(4)由“滤渣3”中主要含有氢氧化铝,先加硫酸溶解,氢氧化铝与硫酸反应生成硫酸铝和水,将硫酸铝溶液转移至蒸发皿中,配制饱和硫酸铵溶液,加入蒸发皿中,蒸发至表面出现晶膜,降温结晶,抽滤,得到铵明矾,洗涤、干燥。所以制备铵明矾的步骤为:a→g→f→c→e→d→b→h,故答案为:f→c→e→d→b。
(5)①由图可知,80℃时Al2(SO4)318H2O的溶解度约为70g,则100g水中可溶解70g晶体,则n[Al2(SO4)318H2O]=70g/666g/mol≈0.1mol,n(H2SO4)=n(SO42-)=0.1mol×3=0.3mol,若H2SO4溶解Al2O3后溶液的体积变化忽略不计,则c(H2SO4)=0.3mol/0.1L=3mol/L,故答案为:A。
②用3mol/L的H2SO4溶解Al2O3后,得到的溶液接近Al2(SO4)318H2O的饱和溶液,有利于铵明矾的制备(可减少蒸发水的量),故答案为:逐滴加入(3 mo1·L-1)硫酸,并不断搅拌,至沉淀恰好完全溶解。


科目:高中化学 来源: 题型:
【题目】辣椒素是辣椒的活性成分,可以预防心脏病,也能缓解肌肉关节疼痛.辣椒素中酯类化合物的结构如图(R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:


已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰;
②化合物J的分子式为C15H22O4;
③R1CHO+R2CH2CHO![]()
![]() +H2O
+H2O
回答下列问题:
(1)G所含官能团的名称为_____________________。
(2)由A和B生成C的化学方程式为_______________________________________。
(3)由C生成D的反应类型为_____________,D的化学名称为_____________________。
(4)由H生成I的化学方程式为_____________________。
(5)J的结构简式为_____________________。
(6)G的同分异构体中,苯环上的一氯代物只有一种的共有____种(不含立体异构),核磁共振氢谱显示2组峰的是_____________________。(写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物结构、性质的说法正确的是
A. 石油的分馏、裂化和煤的干馏都是化学变化
B. 甲烷的一氯代物只有一种可证明甲烷分子呈正四面体形
C. 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
D. 正丁烷和异丁烷的熔沸点相同,它们的一氯取代物都只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:下列说法不正确的是()

A. 当(NH4)2SO4,NH3·H2O的混合溶液呈中性时,c(NH4+) = 2c(SO42-)
B. “浸取”时为了提高锌的浸出率,可采取的措施是搅拌、适当加热
C. “浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为Mn2++H2O2+2NH3·H2O=MnO2+2NH4++2H2O
D. “过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式是NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]= 1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解常数为1.0×10-10。
B. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6mol·L-1
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2(s)+2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,
下列说法不正确的是
A. H2A的电离方程式为:H2A==H++HA- HA-![]() A2-+H+
A2-+H+
B. 室温下,电离平衡HA-![]() A2-+H+的平衡常数Ka=10-3。
A2-+H+的平衡常数Ka=10-3。
C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 20mL0.2mol·L1H2A 溶液中滴加 0.2mol·L1NaOH 溶液,滴加过程中有关微粒的物质的量变化绘制在下图中。下列说法正确的是

A. 当 V(NaOH)=10mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H2A)>c(HA)>c(H+)>c(OH)
B. 当 V(NaOH)=20 mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H+)>c(HA)>c(A2)>c(H2A)
C. 当 V(NaOH)=30 mL 时,溶液中存在以下关系:c(A2)+2c(OH)=c(HA)+c(H+)+3c(H2A)
D. 当 V(NaOH)=40mL 时,溶液中存在以下关系:c(Na+)=2[c(A2)+c(HA)+ c(H2A)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com