
现有A、B、C、D四种金属片,
①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C.
根据上述情况判断四种金属的活泼由强到弱的顺序为()
A. DCAB B. CBAD C. BADC D. BACD
考点: 常见金属的活动性顺序及其应用;原电池和电解池的工作原理.
分析: 一般来说,原电池中,较活泼的金属作负极、较不活泼的金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,电子从负极沿导线流向正极,据此判断金属活动性强弱.
解答: 解:一般来说,原电池中,较活泼的金属作负极、较不活泼的金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,电子从负极沿导线流向正极,
①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生,则A是正极、B是负极,活动性B>A;
②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应,则D是正极、C是负极,活动性C>D;
③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C,则A是负极、C是正极,
活动性A>C,通过以上分析知,金属活动性强弱顺序是B>A>C>D,故选D.
点评: 本题以原电池原理为载体考查金属性强弱判断,明确正负极判断方法是解本题关键,知道电子流向及电流流向,知道正负极与金属活动性强弱关系,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
根据所学知识填写下列空白.
(1)用系统命名法命名: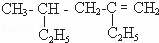 ;
;
(2)写出下列有机物的结构简式:2,6﹣二甲基﹣4﹣乙基辛烷: ;
(3)写出下列反应的化学方程式并分别指出其反应类型:
①将苯与浓硫酸和浓硝酸的混合液共热: ;反应类型为: ;
②1﹣丁烯与氯化氢反应: ;反应类型为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
现有(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,并加热使之充分反应,直至Ba(OH)2溶液过量。加入Ba(OH)2溶液的体积与产生沉淀的质量和放出NH3的体积(标准状况下)的关系如下图,曲线a代表沉淀的质量变化,曲线b代表NH3的体积变化(假设NH3全部放出)。
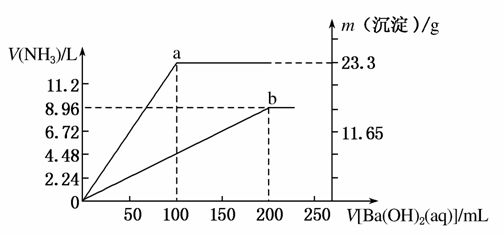
(1)混合溶液中NH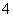 的物质的量为________mol。
的物质的量为________mol。
(2)混合溶液中NO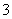 的物质的量为________mol。
的物质的量为________mol。
(3)当加入Ba(OH)2溶液的体积在100~200 mL范围内,发生反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均是短周期元素,A和B同周期,B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2,A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2.请回答
(1)写出元素符号B:C,C:
(2)BA2的电子式,BA2分子中化学键属于共价键..
(3)D2A2的化学式.
(4)C在元素周期表中的位置是第三周期,ⅣA族,其原子结构示意图为.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象都相同的是()
A. Ca(HCO3)2溶液与Ca(OH)2溶液 B. AlCl3溶液与NaOH溶液
C. KAlO2溶液与KHSO4溶液 D. 2%的硝酸银溶液和2%的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视.在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀.为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验.经组成分析,该粉末仅含有O、K、Fe三种元素.
另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g.
(1)3.96g化合物A中含有Fe元素的物质的量为0mol,含有钾元素的物质的量为mol.化合物A的化学式为;
(2)化合物A与H2O反应的离子方程式为:.
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案..
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积为 2L 的密闭容器中,发生反应 2X(g) + Y(g) 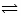 2W(g);△H<0,当充入 2 mol X和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
2W(g);△H<0,当充入 2 mol X和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
①升高温度,W的体积分数减小,△H 增大
②以Y的浓度变化表示的反应速率为 0.01 mol/(L·s)
③在其它条件不变的情况下,增加1 molX,则 X 和Y的转化率均提高
④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
⑤再向容器中通2 molX和1 molY,达到平衡时,X、Y的转化率均增大。
A、①⑤ B、⑤ C、②③④ D、④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com