
”¾ĢāÄæ”æijĀĢÉ«Å©Ņ©½į¹¹¼ņŹ½ĪŖĶ¼1£¬»Ų“šĻĀĮŠĪŹĢā”£
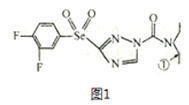
£Ø1£©»łĢ¬ĪųŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ______________£¬øĆÅ©Ņ©×é³ÉŌŖĖŲÖŠ£¬µŚŅ»µēĄėÄܽĻ“óµÄĒ°ČżÖÖŌŖĖŲŹĒ______________(°“Óɓ󵽊”¹ĖŠņÅÅĮŠ)”£
£Ø2£©·Ö×ÓÖŠ±ąŗÅĪŖ¢ŁµÄĢ¼Ō×ÓŗĶÓėĘä³É¼üµÄĮķĶā¼øøöŌ×Ó¹¹³ÉµÄæÕ¼ä½į¹¹ĪŖ____________£»CSe2Ź×“ĪŹĒÓÉH2Se ŗĶCCl4; ·“Ó¦ÖĘČ”µÄ£¬ŹŌ±Č½ĻÉĻŹöČżÖÖ·Ö×ӵļü½Ē_____________(°“³ö“󵽊”Ė³ŠņÅÅĮŠ)”£
£Ø3£©H2SeO3 ·Ö×ÓµÄÖŠŠÄŌ×ÓŌÓ»ÆĄąŠĶŹĒ____________£¬ŹŌ±Č½ĻH2SeO3”¢H2SeO4 ŗĶH2SO4ČżÖÖĖįµÄĖįŠŌĒæČõ(°“ÓÉĒæµ½ČõĖ³ŠņÅÅĮŠ)_______________”£
£Ø4£©ŹÆÄ«ŹĒĢ¼ŌŖĖŲµÄŅ»ÖÖĶ¬ĖŲŅģŠĪĢ壬ŹÆÄ«¾§ĢåæÉæ“×÷ABABA...¶Ń»ż·½Ź½£¬¾§°ū½į¹¹ŗĶ²æ·Ö¾§°ū²ĪŹżČēĶ¼2 ĖłŹ¾; ¼ī½šŹōĄė×ÓæÉĢī³äŌŚŹÆÄ«²ćĪŹŠĪ³ÉŹÆÄ«¼Š²ć»ÆŗĻĪļ£¬Ķ¬Ź±¶Ń»ż·½Ź½“ÓABABAB...±äĪŖAAAA...”£
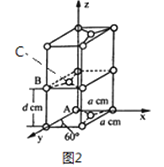
¢ŁŌ×Ó×ų±ź²ĪŹżĆčŹöµÄŹĒ¾§°ūÄŚŌ×Ó¼äµÄĻą¶ŌĪ»ÖĆ”£ŹÆÄ«¾§°ūÖŠĢ¼Ō×ÓA”¢B µÄ×ų±ź²ĪŹż·Ö±šĪŖ: A£Ø0£¬0£¬0)”¢B(0£¬1£¬1/2)”£ŌņC Ō×ÓµÄ×ų±ź²ĪŹżĪŖ_____________£¬”£
¢Ś¾§°ū²ĪŹżÓĆŅŌĆčŹöĘ·°ūµÄ“óŠ”ŗĶŠĪד”£ŅŃÖŖŹÆÄ«¾§°ūµ×±ß³¤ĪŖa pm£¬²ć¼ä¾ąĪŖd pm£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£¬ŌņŹÆÄ«µÄĆܶČĪŖ_____________g/cm3 (Š“³ö±ķ“ļŹ½¼“æÉ)”£
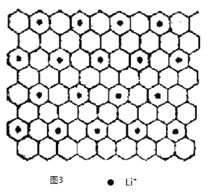
¢ŪĶ¼3ĪŖŹÆÄ«¼Š²ć»ÆŗĻĪļW µÄĶ¶Ó°Ķ¼£¬ŹŌŠ“³öW µÄ»ÆѧŹ½_____________£¬Ī¢Į£Ö®¼ä“ęŌŚµÄ»Æѧ¼üÓŠ_____________£¬
”¾“š°ø”æ [Ar] 3d104s24p4 F>N>O ĖÄĆęĢåŠĪ Cse2> CCl4> H2Se sp3”¢sp3 H2SO4> H2SeO4> H2SeO3 (1/3£¬2/3£¬1/2) 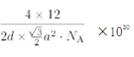 C8Li Ąė×Ó¼üŗĶ¹²¼Ū¼ü
C8Li Ąė×Ó¼üŗĶ¹²¼Ū¼ü
”¾½āĪö”æ±¾ĢāÖ÷ŅŖæ¼²éĪļÖŹ½į¹¹”£
£Ø1£©»łĢ¬ĪųŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ[Ar]3d104s24p4£¬øĆÅ©Ņ©×é³ÉŌŖĖŲÖŠ£¬µŚŅ»µēĄėÄܽĻ“óµÄĒ°ČżÖÖŌŖĖŲŹĒF”¢C”¢N£¬Ņ»°ć·Ē½šŹōŠŌŌ½Ē棬µŚŅ»µēĄėÄÜŌ½“󣬷Ē½šŹōŠŌ£ŗF>O>N£¬¶ųĒŅÓÉÓŚµŖŌ×Ó×īĶā²ćµē×Ó“¦ÓŚ°ė³äĀśµÄ½ĻĪȶØדĢ¬£¬Ź¹µĆµŖµÄµŚŅ»µēĄėÄÜ“óÓŚŃõ£¬ĖłŅŌµŚŅ»µēĄėÄÜ£ŗF>N>O”£
£Ø2£©·Ö×ÓÖŠ±ąŗÅĪŖ¢ŁµÄĢ¼Ō×ÓŗĶÓėĘä³É¼üµÄĮķĶā¼øøöŌ×ÓŠĪ³Éµ„¼ü£¬¹¹³ÉµÄæÕ¼ä½į¹¹ĪŖĖÄĆęĢåŠĪ£»CSe2ÓėCO2ŹĒµČµē×ÓĢ壬CSe2ŹĒÖ±ĻߊĪ·Ö×Ó£¬¼ü½ĒŹĒ120”ć£¬H2SeÓėH2OŹĒµČµē×ÓĢ壬H2SeµÄ¼ü½ĒŠ”ÓŚ109.5”ć£¬CCl4ŹĒÕżĖÄĆęĢåŠĪ·Ö×Ó£¬¼ü½ĒŹĒ109.5”ć£¬ĖłŅŌÉĻŹöČżÖÖ·Ö×ӵļü½ĒCse2>CCl4>H2Se”£
£Ø3£©H2SeO3·Ö×ÓÓŠĮ½øöōĒ»ł£¬ÖŠŠÄŌ×Ó¼Ū²ćµē×Ó¶ŌĪŖ4£¬ŌÓ»ÆĄąŠĶŹĒsp3£¬H2SeO3”¢H2SeO4ŗĶH2SO4ČżÖÖĖįµÄ·ĒōĒ»łŃõŌ×ÓŹż·Ö±šŹĒ1”¢2”¢2£¬·Ē½šŹōŠŌ£ŗS>Se£¬ĖłŅŌĖįŠŌ£ŗH2SO4>H2SeO4>H2SeO3”£
£Ø4£©¢ŁŹÆÄ«¾§°ūÖŠĢ¼Ō×ÓA”¢B µÄ×ų±ź²ĪŹż·Ö±šĪŖ: A£Ø0£¬0£¬0)”¢B(0£¬1£¬1/2)£¬ŌņCŌ×ÓµÄ×ų±ź²ĪŹżĪŖ(1/3£¬2/3£¬1/2)”£
¢ŚŹÆÄ«¾§°ūĮłŌŖ»·Ę½¾łŗ¬ÓŠ2øöĢ¼Ō×Ó£¬µ×Ć껿ĪŖ![]() a2pm2£¬¾§°ūĢå»żĪŖd”Į
a2pm2£¬¾§°ūĢå»żĪŖd”Į![]() a2pm3£¬ŌņŹÆÄ«µÄĆܶČĪŖ
a2pm3£¬ŌņŹÆÄ«µÄĆܶČĪŖ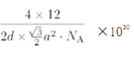 g/cm3(Š“³ö±ķ“ļŹ½¼“æÉ)”£
g/cm3(Š“³ö±ķ“ļŹ½¼“æÉ)”£
¢ŪĘ½¾łĆæ4øöĮłŌŖ»·ŗ¬ÓŠ1øöLi+£¬ĆæøöĮłŌŖ»·Ę½¾łŗ¬ÓŠ2øöĢ¼Ō×Ó£¬ĖłŅŌWµÄ»ÆѧŹ½ĪŖC8Li£¬Ī¢Į£Ö®¼ä“ęŌŚµÄ»Æѧ¼üÓŠ½šŹōŌ×ÓÓė·Ē½šŹōŌ×ÓÖ®¼äŠĪ³ÉµÄĄė×Ó¼üŗĶ·Ē½šŹōŌ×ÓÖ®¼äµÄ¹²¼Ū¼ü”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĄė×Ó·½³ĢŹ½ÖŠ£¬ÕżČ·µÄŹĒ( ””””)
A. Na2O2¹ĢĢåČÜÓŚ×ćĮæĖ®ÖŠ£ŗ2O![]() £«2H2O===4OH££«O2”ü
£«2H2O===4OH££«O2”ü
B. Ģ¼ĖįĒāøĘČÜŅŗÖŠµĪČėÉŁĮæµÄNaOHČÜŅŗ£ŗCa2£«£«HCO![]() £«OH£===CaCO3”ż£«H2O
£«OH£===CaCO3”ż£«H2O
C. “ĪĀČĖįøĘČÜŅŗÖŠĶØČė¹żĮæµÄCO2£ŗCa2£«£«2ClO££«CO2£«H2O===CaCO3”ż£«2HClO
D. ĻõĖįĀĮČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£ŗAl3£«£«4OH£===AlO![]() £«2H2O
£«2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijӊ»śĪļX£ØC13H14O8£©·Ö×ÓÖŠŗ¬ÓŠ¶ąÖÖ¹ŁÄÜĶÅ£¬Ęä½į¹¹ĪŖ 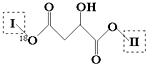 £ØĘäÖŠI”¢IIĪŖĪ“ÖŖ²æ·ÖµÄ½į¹¹£©£ŗĪŖĶĘ²āXµÄ·Ö×Ó½į¹¹£¬ĻÖ½ųŠŠČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ£®
£ØĘäÖŠI”¢IIĪŖĪ“ÖŖ²æ·ÖµÄ½į¹¹£©£ŗĪŖĶĘ²āXµÄ·Ö×Ó½į¹¹£¬ĻÖ½ųŠŠČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ£® 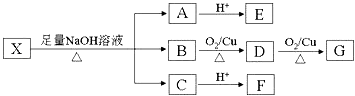
ŅŃÖŖ£ŗ¢ŁE·Ö×ÓÖŠ¼ģ²āµ½18OŌ×Ó£¬ĻņEµÄĖ®ČÜŅŗÖŠµĪČėFeCl3ČÜŅŗĻŌ×ĻÉ«£¬EµÄŗĖ“Ź²ÕńĒāĘ×ÖŠÓŠ4×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ1£ŗ2£ŗ2£ŗ1£¬EÓėNaHCO3·“Ó¦ÓŠCO2²śÉś£»¢ŚGµÄ·Ö×ÓŹ½ĪŖC2H2O4 £® Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©E·Ö×ÓĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘŹĒ£»XČÜŅŗÓöFeCl3ČÜŅŗ²»ĻŌ×ĻÉ«£¬ŌņXµÄ½į¹¹¼ņŹ½ĪŖ £®
£Ø2£©Š“³öBÓėG·“Ӧɜ³ÉM£Ø·Ö×ÓÄŚŗ¬ÓŠĮłŌŖ»·£©µÄ»Æѧ·½³ĢŹ½£ŗ £®
£Ø3£©FÓŠĢŲŹāÓäæģµÄĖįĪ¶£¬æÉ×÷ĪŖŹ³Ę·ŅūĮĻµÄĢķ¼Ó¼Į£»FµÄ¾ŪŗĻĪļ¾ßÓŠĮ¼ŗƵÄÉśĪļĻąČŻŠŌ£¬æÉ×÷ĪŖŹÖŹõ·ģŗĻĻßµČ²ÄĮĻ¹ć·ŗÓ¦ÓĆÓŚÉśĪļŅ½Ņ©ŗĶÉśĪļ²ÄĮĻĮģÓņ£®ÓÉB¾¹żĻĀĮŠĶ¾¾¶æÉŗĻ³ÉF£ŗ ![]()
ŅŃÖŖ£ŗRCH2COOH ![]()
![]() £»RCH2Br
£»RCH2Br ![]() RCH2COOH
RCH2COOH
¢ŁN”śTµÄ·“Ó¦ĄąŠĶŹĒ £¬ NµÄ½į¹¹¼ņŹ½ŹĒ £®
¢ŚŠ“³öT”śFµÄµŚŅ»²½·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ £®
£Ø4£©EÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬Š“³ö·ūŗĻĻĀĮŠĢõ¼žµÄĖłÓŠĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½£ŗ £®
¢ŁŹōÓŚ·¼Ļć×å»ÆŗĻĪļ£»¢ŚÄÜ·¢ÉśŅų¾µ·“Ó¦£»¢Ū±½»·ÉĻµÄŅ»ĀČ“śĪļÖ»ÓŠ2ÖÖ£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠµ¼µēŠŌ×ī²īµÄŹĒ£Ø £©
A.ČŪČŚµÄNaOHB.ŹÆÄ«°ōC.ŃĪĖįD.KCl¹ĢĢå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ£¬ŹōÓŚ·Ēµē½āÖŹµÄŹĒ£Ø £©
A.ŅŅ“¼B.KNO3¾§ĢåC.ĶD.CaCO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄܹ»ÓĆĄ“¼ų±šBaCl2”¢ NaCl”¢ Na2CO3ČżÖÖĪļÖŹµÄŹŌ¼ĮŹĒ£Ø £©
A. AgNO3ČÜŅŗ B. Ļ”ĮņĖį C. Ļ”ŃĪĖį D. Ļ”ĻõĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĻĀĮŠŹµŃéŹĀŹµ£ŗ
¢Ł![]() ¹ĢĢå¼ČÄÜČÜÓŚ
¹ĢĢå¼ČÄÜČÜÓŚ![]() ČÜŅŗµĆµ½
ČÜŅŗµĆµ½![]() ČÜŅŗ£¬ÓÖÄÜČÜÓŚĮņĖįµĆµ½
ČÜŅŗ£¬ÓÖÄÜČÜÓŚĮņĖįµĆµ½![]() ČÜŅŗ£»
ČÜŅŗ£»
¢ŚĻņ![]() ČÜŅŗÖŠµĪ¼Ó
ČÜŅŗÖŠµĪ¼Ó![]() ČÜŅŗ£¬ŌŁĖį»Æ£¬æɵĆ
ČÜŅŗ£¬ŌŁĖį»Æ£¬æɵĆ![]() ČÜŅŗ£»
ČÜŅŗ£»
¢Ū½«![]() ČÜŅŗµĪ¼Óµ½µķ·ŪŗĶKIµÄ»ģŗĻČÜŅŗÖŠ£¬ČÜŅŗ±äĄ¶”£
ČÜŅŗµĪ¼Óµ½µķ·ŪŗĶKIµÄ»ģŗĻČÜŅŗÖŠ£¬ČÜŅŗ±äĄ¶”£
ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ
A. »ÆŗĻĪļ![]() ÖŠ
ÖŠ![]() ŌŖĖŲĪŖ+3¼Ū
ŌŖĖŲĪŖ+3¼Ū
B. ŹµŃé¢ŁÖ¤Ć÷![]() ŹĒĮ½ŠŌŃõ»ÆĪļ
ŹĒĮ½ŠŌŃõ»ÆĪļ
C. ŹµŃé¢ŚÖ¤Ć÷![]() ¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌ
¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌ
D. ŹµŃé¢ŪÖ¤Ć÷Ńõ»ÆŠŌ£ŗ ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°±ŹĒ×īÖŲŅŖµÄµŖ·Ź£¬ŹĒ²śĮæ×ī“óµÄ»Æ¹¤²śĘ·Ö®Ņ»£®µĀ¹śČĖ¹ž²®ŌŚ1905Äź·¢Ć÷ĮĖŗĻ³É°±µÄ·½·Ø£¬ĘäŗĻ³ÉŌĄķĪŖ£ŗN2£Øg£©+3H2£Øg£©2NH3£Øg£©”÷H=©92.4kJmol©1 £¬ ĖūŅņ“Ė»ńµĆĮĖ1918ÄźÅµ±“¶ū»Æѧ½±£® ŌŚĆܱÕČŻĘ÷ÖŠ£¬Ź¹2mol N2ŗĶ6mol H2»ģŗĻ·¢ÉśĻĀĮŠ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©2NH3£Øg£©£ØÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£©
£Ø1£©µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬N2ŗĶH2µÄ×Ŗ»ÆĀŹ±ČŹĒ £®
£Ø2£©ÉżøßĘ½ŗāĢåĻµµÄĪĀ¶Č£Ø±£³ÖĢå»ż²»±ä£©£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ £¬
ĆÜ¶Č £® £ØĢī”°±ä“ó”±”°±äŠ””±»ņ”°²»±ä”±£©
£Ø3£©µ±“ļµ½Ę½ŗāŹ±£¬³äČėė²Ęų£¬²¢±£³ÖŃ¹Ēæ²»±ä£¬Ę½ŗā½«£ØĢī”°ÕżĻņ”±”°ÄęĻņ”±»ņ”°²»”±£©ŅĘ¶Æ£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ80”ꏱ£¬½«0.40molµÄN2O4ĘųĢå³äČė2LŅŃ¾³éæյĹĢ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗN2O42NO2 £¬ øōŅ»¶ĪŹ±¼ä¶ŌøĆČŻĘ÷ÄŚµÄĪļÖŹ½ųŠŠ·ÖĪö£¬µĆµ½ČēĻĀŹż¾Ż£ŗ
Ź±¼ä/s | 0 | 20 | 40 | 60 | 80 | 100 |
n£ØN2O4£© | 0.40 | a | 0.20 | c | d | e |
n£ØNO2£© | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
£Ø1£©¼ĘĖć20”«40sÄŚÓĆN2O4±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖmolL©1s©1 £®
£Ø2£©¼ĘĖćŌŚ80”ꏱøĆ·“Ó¦µÄĘ½ŗā³£ŹżK= £®
£Ø3£©·“Ó¦½ųŠŠÖĮ100sŗ󽫷“Ó¦»ģŗĻĪļµÄĪĀ¶Č½µµĶ£¬»ģŗĻĘųĢåµÄŃÕÉ«£ØĢī”°±äĒ³”±”¢”°±äÉī”±»ņ”°²»±ä”±£©£®
£Ø4£©ŅŖŌö“óøĆ·“Ó¦µÄKÖµ£¬æɲÉČ”µÄ“ėŹ©ÓŠ£ØĢī×ÖÄø£©£®
a£®Ōö“óN2O4ĘšŹ¼ÅضČ
b£®Ļņ»ģŗĻĘųĢåÖŠĶØČėNO2
c£®Ź¹ÓĆøߊ§“߻ƼĮ
d£®ÉżøßĪĀ¶Č£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com