
| A. | 该有机物含碳、氢、氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳、氢原子个数之比是1:3 | |
| D. | 该化合物分子中含2个碳原子,6个氢原子,但不能确定是否含氧分子 |
分析 某有机物完全燃烧时只生成水和二氧化碳,且两者的物质的量之比为3:2,则有机物一定含C、H元素,且H、C原子个数比为3×2:2=3:1,可能为乙烷或乙醇等,乙醇来解答.
解答 解:A.一定含C、H元素,可能含O元素,故A错误;
B.有机物中H、C原子个数比为3×2:2=3:1,可能为乙烷或乙醇,故B错误;
C.由水和二氧化碳的物质的量之比为3:2可知,该化合物分子中碳、氢原子个数之比是1:3,故C正确;
D.该有机物分子中一定不含氧分子,故D错误;
故选C.
点评 本题考查有机物分子式计算的确定,为高频考点,把握燃烧规律、原子守恒为解答的关键,侧重分析与计算能力的考查,注意有机物不一定为烃,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
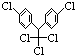 ,有关它的说法正确的是( )
,有关它的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共面 | ||
| C. | 分子式为C14H8Cl5 | D. | 1 mol该物质能与6 molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 用相同的盐酸中和体积,物质的量浓度均相同的氢氧化钠和氨水溶液,所需盐酸的量相等 | |
| C. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的50% | |
| D. | 氢氧化钠溶液的物质的量浓度是氨水的两倍,则氢氧化钠的OH-浓度也是氨水溶液的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、SO42-、Na+、K+ | B. | K+、Fe2+、Na+、NO3- | ||
| C. | HCO3-、Na+、NO3-、K+ | D. | NO3-、Ba2+、Cl-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol水的摩尔质量和1 mol水的摩尔质量 | |
| B. | 1 mol/L氯化钙溶液中n(Cl-)和2 mol/L氯化钾溶液中n(Cl-) | |
| C. | 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 | |
| D. | 20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
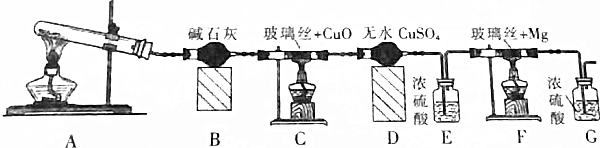
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com