
”¾ĢāÄæ”æŌŚČŻ»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬ĶØČĖ0.02 mol O2(g)ŗĶ0.02 mol SO2(g)£¬ŌŚŅ»¶ØĢõ¼žĻĀ·“Ӧɜ³ÉSO3ĘųĢ壬µ±·“Ó¦½ųŠŠµ½5minŹ±£¬²āµĆČŻĘ÷ÄŚÓŠ0.012 mol SO3(g)”£Ōņ£ŗ
(1)5minŹ±£¬ČŻĘ÷ÄŚn(O2 )=______c(SO2) =_______
(2)0~5 minÄŚ£¬ŅŌO2±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(O2)=______
(3)5minŹ±£¬ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÓė·“Ó¦Ē°ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÖ®±ČĪŖ___
(4)Čō·“Ó¦½ųŠŠµ½10minŹ±“ļµ½Ę½ŗā£¬“ĖŹ±c(SO2)+c(SO3) = _______
”¾“š°ø”æ0.014mol 0.004mol/L 0.0006mol”¤L-1”¤min-1 17:20 0.01mol/L
”¾½āĪö”æ
2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬ĶØČĖ0.02 mol O2(g)ŗĶ0.02 mol SO2(g)£¬øł¾ŻČż¶ĪŹ½£ŗ

¼ĘĖćn(O2 )”¢c(SO2) ”¢v(O2)ŅŌ¼°5minŹ±£¬ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÓė·“Ó¦Ē°ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÖ®±Č”£
£Ø1£©2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬ĶØČĖ0.02 mol O2(g)ŗĶ0.02 mol SO2(g)£¬øł¾Ż·“Ó¦µÄČż¶ĪŹ½£ŗ

5minŹ±£¬ČŻĘ÷ÄŚn(O2 )=0.014mol£¬![]() £¬¹Ź“š°øĪŖ£ŗ0.014mol£»0.004mol/L”£
£¬¹Ź“š°øĪŖ£ŗ0.014mol£»0.004mol/L”£
£Ø2£©0~5minÄŚ£¬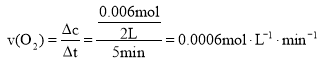 £¬¹Ź“š°øĪŖ£ŗ0.0006mol”¤L-1”¤min-1”£
£¬¹Ź“š°øĪŖ£ŗ0.0006mol”¤L-1”¤min-1”£
£Ø3£©5minŹ±£¬ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÓė·“Ó¦Ē°ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÖ®±ČĪŖ£ŗ![]() £¬¹Ź“š°øĪŖ£ŗ17:20”£
£¬¹Ź“š°øĪŖ£ŗ17:20”£
£Ø4£©øł¾ŻÖŹĮæŹŲŗć¶ØĀÉ£¬³äČė0.02mol SO2(g)£¬²æ·ÖÉś³ÉSO3(g)£¬n(SO2)+n(SO3)=0.02mol£¬Ģå»żĪŖ2L£¬Ōņc(SO2)+c(SO3)=0.01molL-1£¬¹Ź“š°øĪŖ£ŗ0.01molL-1”£


 æĘѧŹµŃé»ī¶Æ²įĻµĮŠ“š°ø
æĘѧŹµŃé»ī¶Æ²įĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°±ĪŖÖŲŅŖ»Æ¹¤ŌĮĻ£¬ÓŠ¹ć·ŗÓĆĶ¾”£
(1)ŗĻ³É°±ÖŠµÄĒāĘųæÉÓÉĻĀĮŠ·“Ó¦ÖĘČ”£ŗ
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ”÷H=+216.4KJ/mol
CO(g)+3H2(g) ”÷H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) ”÷H=-41.2kJ/mol
CO2(g)+H2(g) ”÷H=-41.2kJ/mol
Ōņ·“Ó¦CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ”÷H=______”£
CO2(g)+4H2(g) ”÷H=______”£
(2)ĘšŹ¼Ź±Ķ¶ČėµŖĘųŗĶĒāĘų·Ö±šĪŖ1mol”¢3mol£¬ŌŚ²»Ķ¬ĪĀ¶ČŗĶŃ¹ĒæĻĀŗĻ³É°±”£Ę½ŗāŹ±»ģŗĻĪļÖŠ°±µÄĢå»ż·ÖŹżÓėĪĀ¶Č¹ŲĻµČēĶ¼”£

¢ŁŗćŃ¹Ź±£¬·“Ó¦Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ______(ĢīŠņŗÅ)£ŗ
A.N2ŗĶH2µÄ×Ŗ»ÆĀŹĻąµČ B.·“Ó¦ĢåĻµĆܶȱ£³Ö²»±ä
C.![]() µÄ±ČÖµĪŖ3:2 D.
µÄ±ČÖµĪŖ3:2 D.![]() =2
=2
¢ŚP1______P2(Ģī”°>”±”¢”°<”±”¢”°=”±£¬ĻĀĶ¬)£ŗ·“Ó¦Ę½ŗā³£Źż£ŗBµć______Dµć£»
¢ŪCµćH2µÄ×Ŗ»ÆĀŹ______£»(ŹżÖµ±£Įō0.1%)ŌŚA”¢BĮ½µćĢõ¼žĻĀ£¬øĆ·“Ó¦“ÓæŖŹ¼µ½Ę½ŗāŹ±Éś³ÉĒāĘųĘ½¾łĖŁĀŹ£ŗv(A)______v(B)(Ģī”°>”±”¢”°<”±”¢”°=”±)”£
(3)ŅŃÖŖ25”ꏱÓÉNa2SO3ŗĶNaHSO3ŠĪ³ÉµÄ»ģŗĻČÜŅŗĒ”ŗĆ³ŹÖŠŠŌ£¬ŌņøĆ»ģŗĻČÜŅŗÖŠø÷Ąė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņĪŖ______________(ŅŃÖŖ25”ꏱ£¬H2SO3µÄµēĄėĘ½ŗā³£ŹżKa1=1”Į10-2£¬Ka2=1”Į10-7)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§ÉśĪŖĮĖĢ½¾æŠæÓėŃĪĖį·“Ó¦¹ż³ĢÖŠµÄĖŁĀŹ±ä»Æ£¬ĖūŌŚ100mLĻ”ŃĪĖįÖŠ¼ÓČė×ćĮæµÄŠæ·Ū£¬ÓĆÅÅĖ®¼ÆĘų·ØŹÕ¼Æ·“Ó¦·Å³öµÄĒāĘų£¬ŹµŃé¼ĒĀ¼ČēĻĀ£Ø±ķÖŠĘųĢåĢå»żĪŖĄŪ¼ĘÖµ£¬ĒŅŅŃ×Ŗ»ÆĪŖ±ź×¼×“æö£©£ŗ
Ź±¼ä£Ømin£© | 1 | 2 | 3 | 4 | 5 |
ĒāĘųĢå»ż£ØmL£© | 50 | 120 | 232 | 290 | 310 |
¢ŁÄÄŅ»Ź±¼ä¶Ī£ØÖø0”«1”¢1”«2”¢2”«3”¢3”«4”¢4”«5min£©·“Ó¦ĖŁĀŹ×ī“ó_____min£¬ŌŅņŹĒ_________________£®
¢ŚÄÄŅ»¶ĪŹ±¶ĪµÄ·“Ó¦ĖŁĀŹ×īŠ”_____min£¬ŌŅņŹĒ_____________£®
¢ŪĒó2”«3·ÖÖÓŹ±¼ä¶ĪŅŌŃĪĖįµÄÅØ¶Č±ä»ÆĄ“±ķŹ¾µÄøĆ·“Ó¦ĖŁĀŹ_____________£ØÉčČÜŅŗĢå»ż²»±ä£©
¢ÜČē¹ū·“Ó¦Ģ«¼¤ĮŅ£¬ĪŖĮĖ¼õ»ŗ·“Ó¦ĖŁĀŹ¶ųÓÖ²»¼õÉŁ²śÉśĒāĘųµÄĮ棬ĖūŌŚŃĪĖįÖŠ·Ö±š¼ÓČėµČĢå»żµÄĻĀĮŠČÜŅŗ£ŗ
A.ÕōĮóĖ®£»B.NaClČÜŅŗ£»C.NaNO3ČÜŅŗ£»D.CuSO4ČÜŅŗ£»E.Na2CO3ČÜŅŗ£¬ÄćČĻĪŖæÉŠŠµÄŹĒ_____£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ1mol°×Į×£ØP4£¬s£©ŗĶ4molŗģĮ×£ØP£¬s£©ÓėŃõĘų·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĶ¼£ØE±ķŹ¾ÄÜĮ棩”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
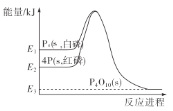
A. P4(s£¬°×Į×)=4P(s£¬ŗģĮ×) ¦¤H£¾0
B. ŅŌÉĻ±ä»ÆÖŠ£¬°×Į×ŗĶŗģĮ×ĖłŠč»ī»ÆÄÜĻąµČ
C. °×Į×±ČŗģĮ×ĪȶØ
D. ŗģĮ×Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ŹĒ4P(s£¬ŗģĮ×)£«5O2(g)£½P4O10(s) ¦¤H=£(E2£E3)kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A. 0.1mol”¤L£1K2CO3ČÜŅŗÖŠ£ŗc(H+)+c(HCO3£)+2c(H2CO3)=c(OH£)
B. ŅŃÖŖKsp(AgCl)£¾Ksp(AgBr)£¬½«AgClŗĶAgBrµÄ±„ŗĶČÜŅŗµČĢå»ż»ģŗĻ£¬ŌŁ¼ÓČė×ćĮæµÄÅØAgNO3ČÜŅŗ£¬AgCl³Įµķ¶ąÓŚAgBr³Įµķ
C. ³£ĪĀĻĀ£¬pH=4.75”¢ÅØ¶Č¾łĪŖ0.1mol/L µÄCH3COOH”¢CH3COONa »ģŗĻČÜŅŗ£ŗc(CH3COO£)£«c(OH£)£¼c(CH3COOH)£«c(H£«)
D. ŅŃÖŖKsp(AgCl)£½1.8”Į10£10£¬Ksp(Ag2CrO4)£½2.0”Į10£12£¬ĻņÅØ¶Č¾łĪŖ1”Į10£3mol/L µÄKCl ŗĶK2CrO4»ģŗĻŅŗÖŠµĪ¼Ó1”Į10£3mol/LAgNO3ČÜŅŗ£¬Cl£ĻČŠĪ³É³Įµķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æag ĻõĖį¼ŲČÜÓŚbgĖ®£¬ŠĪ³ÉVmL±„ŗĶČÜŅŗ”£ĻĀĮŠ¹ŲĻµŹ½“ķĪóµÄŹĒ(””””)
A. øĆČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č£ŗc(KNO3)£½![]() mol”¤L£1
mol”¤L£1
B. øĆČÜŅŗµÄÖŹĮæ·ÖŹż£ŗw(KNO3)£½![]() %
%
C. 20 ”ꏱKNO3µÄČܽā¶ČS£½![]() g
g
D. øĆČÜŅŗµÄĆÜ¶Č¦Ń£½![]() g”¤L£1
g”¤L£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆѧÓĆÓļŹéŠ“ÕżČ·µÄŹĒ(””””)
A. Ģś·ŪĶ¶Čėµ½NaHSO4ČÜŅŗÖŠµÄĄė×Ó·½³ĢŹ½:Fe+2HSO4”Ŗ=Fe2++H2”ü+ 2SO42”Ŗ
B. HS-µÄµēĄė·½³ĢŹ½: HS-+H2O=== H3O£«£«S2-
C. Ņŗ°±Ņ²æÉĻńĖ®Ņ»Ńł·¢Éś×ŌżµēĄė£ŗ2NH3![]() NH4£«£«NH2”Ŗ
NH4£«£«NH2”Ŗ
D. Ė«ŃõĖ®¾ßÓŠČõĖįŠŌ£¬ĘäµēĄė·½³ĢŹ½: H2O2![]() 2H£«£«O22-
2H£«£«O22-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖµ„ÖŹĶÓėĻ”ĻõĖįµÄ·“Ó¦ĪŖ3Cu£«8HNO3=2NO”ü£«4H2O£«3Cu(NO3)2(CuµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ64)”£ĻÖ°Ń19.2 g Cu·ÅČė200 mL 5 mol”¤L£1ĻõĖįÖŠ£¬³ä·Ö·“Ó¦£¬ĪŹ£ŗ
(1)²Ī¼Ó·“Ó¦µÄĻõĖįµÄĪļÖŹµÄĮæĪŖ¶ąÉŁ£æ______________
(2)ŌŚ±ź×¼×“æöĻĀ²śÉśµÄĘųĢåµÄĢå»żĪŖ¶ąÉŁ£æ____________
(3Éś³ÉĖ®µÄ·Ö×ÓŹżĪŖ¶ąÉŁ£æ___________
(4)Čō·“Ó¦Ē°ŗóČÜŅŗµÄĢå»ż²»±ä£¬ŌņÉś³ÉCu(NO3)2µÄĪļÖŹµÄĮæÅضČĪŖ¶ąÉŁ£æ__________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķŹĒ³£ĪĀĻĀ¼øÖÖ³£¼ūČõĖįµÄµēĄėĘ½ŗā³£Źż:
ČõĖį | µēĄė·½³ĢŹ½ | µēĄėĘ½ŗā³£ŹżK |
CH3COOH | CH3COOH | K=1.6”Į10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9”Į10-2 K2=6.4”Į10-5 |
H2CO3 | H2CO3 | K1=4.4”Į10-7 K2=5.6”Į10-11 |
H2S | H2S | K1£½9.1”Į10£8K2£½1.1”Į10£15 |
»Ų“šĻĀĮŠĪŹĢā:
(1)ijĪĀ¶ČĻĀ£¬“æĖ®ÖŠµÄc£ØH+£©=2£®0”Į10-7mol/L£¬Ōņ“ĖŹ±ČÜŅŗÖŠc£ØOH-£©ĪŖ_______mol/L£»“ĖŹ±ĪĀ¶Č__________25 ”ę£ØĢī”°“óÓŚ”±£¬”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£¬ČōĪĀ¶Č²»±ä£¬µĪČėĻ”ĮņĖįŹ¹c£ØH+£©=5£®0”Į10-6mol/L£¬ŌņÓÉĖ®µēĄė³öµÄc£ØH+£©ĪŖ______mol/L”£
(2)ĻĀĮŠĖÄÖÖĄė×Ó½įŗĻH+ÄÜĮ¦×īĒæµÄŹĒ______”£
A£®HCO3- B£® C2O42- C£® S2£ D£®CH3COO-
(3)øĆĪĀ¶ČĻĀ1.0 mol”¤L-1µÄCH3COOHČÜŅŗÖŠµÄc(H+)=_____span> mol”¤L-1 ””
(4)³£ĪĀĻĀ£¬¼ÓĖ®Ļ”ŹĶ0.1 mol”¤L-1µÄH2C2O4ČÜŅŗ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø______£©
A£®ČÜŅŗÖŠn(H£«)”Įn(OH£)±£³Ö²»±ä
B£®ČÜŅŗÖŠĖ®µēĄėµÄc(H£«)”Įc(OH£)±£³Ö²»±ä
C£®ČÜŅŗÖŠc(HC2O4-)/c(H2C2O4)±£³Ö²»±ä
D£®ČÜŅŗÖŠc(OH£)Ōö“ó
(5)½«CH3COOHČÜŅŗ¼ÓČėÉŁĮæNa2CO3ČÜŅŗÖŠ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com