
下列过程一定涉及氧化还原反应的是( )
A.萃取 B.电解 C.净水 D.分馏
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
氮、磷、锌、铁等是与生命活动密不可分的元素。请回答下列问题:
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是 。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是 。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式
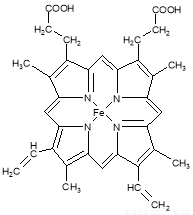

血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1):
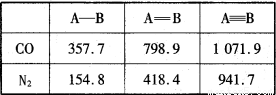
结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:填空题
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
元素 | A | B | C | D | E |
相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
回答以下问题(化学用语中的元素用相应的元素符号表示)。
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。

查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:选择题
制备乙酸乙酯的绿色合成路线之一为:

下列说法不正确的是
A.M的分子式为C6H12O6 B.N的结构简式为CH3COOH
C.④的反应类型属于取代反应 D.淀粉与纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:选择题
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH4O + 3O2 = 2CO2↑+ 4H2O,下图是该燃料电池的示意图。下列说法错误的是( )
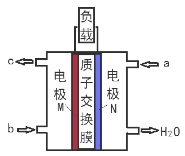
A.燃料电池将化学能转化为电能
B. a是甲醇、b是氧气
C.质子从M电极区穿过交换膜移向N电极区
D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
向盛有硝酸银水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到无色的透明溶液,下列对此现象的说法正确的是( )
A.反应前后Ag+的浓度不变
B.沉淀溶解后,生成[Ag (NH3) 2] OH难电离
C.配合离子[Ag (NH3)2] + 存在离子键和共价键
D.配合离子[Ag (NH3)2] +中,Ag+提供空轨道,NH3给出孤对电子
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,有良好的绝缘性、阻燃,在电器工业方面具有广泛用途。下列推测正确的是( )
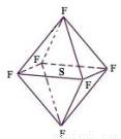
A.SF6中各原子均达到8电子稳定结构 B.SF6二氯取代物有3种
C.SF6分子是含有极性键的非极性分子 D.SF6是原子晶体
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:填空题
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应 中生成的CO2气体体积随反应时间变化的情况,绘制曲线。请分析讨论以下问题。
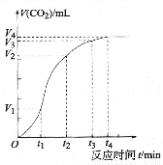
(1)碳酸钙与稀盐酸的反应是放热反应,这是由于反应物的总能量______(填“大于”或“小于”)生成物的总能量。
(2)在0~t1、t1~t2、t2~t3、t3~t4各相同的时间段里, 收集到气体最多的是_____时间段。反应速率最大的是__________时间段,反应速率最小的是__________时间段。
(3)t1~t2时间段里影响反应速率的主要外界因素是 、t2~t3时间段里影响反应速率的主要外界因素是 (填“温度”或“浓度” 或“压强” 或“催化剂”)(提醒:多填不得分)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:实验题
(15分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
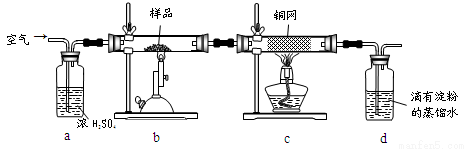
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的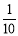 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
A.除去SO2气体 B.除去空气中的水蒸气 C.有利于气体混合
D.有利于观察空气流速 E.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
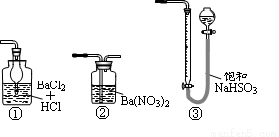
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com