
异苯丙醛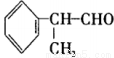 在工业上有重要用途,其合成流程如下:
在工业上有重要用途,其合成流程如下:
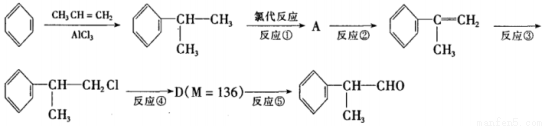
(1)异苯丙醛被酸性高锰酸钾氧化后所得有机物的结构简式是____________。
(2)在合成流程上②的反应类型是____________,反应④发生的条件是____________,
(3)反应⑤的化学方程式为____________。
(4)异苯丙醛发生银镜反应的化学方程式为__________。
(5)D物质与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的名称是____________。D物质有多种同分异构体,其中满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有____________种。
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2015-2016学年辽宁东北育才学校高二下第二段考化学试卷(解析版) 题型:选择题
已知吡啶( )与苯环性质相似。有机物M与磷酸在一定条件下形成磷酸吡醛,
)与苯环性质相似。有机物M与磷酸在一定条件下形成磷酸吡醛, (M)+H3PO4
(M)+H3PO4 H2O+
H2O+ (磷酸吡醛),磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
(磷酸吡醛),磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
A.M能使酸性高锰酸钾溶液褪色
B.1 mol M能与金属钠反应,消耗2 mol Na
C.1 mol磷酸吡醛与NaOH溶液反应,最多消耗3 mol NaOH
D.M与足量H2反应后所得有机物的分子式为C8H17O3N
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三考前高考模拟十化学试卷(解析版) 题型:选择题
分子式为C9H18O2的有机物A,它能在酸性条件下水解生成B和C,其中C不与NaHCO3溶液反应,1 mol C完全燃烧产生的气体与足量澄清石灰水反应能生成400g沉淀。则有机物A的可能结构有(不考虑立体异构)
A.4种 B.8种
C.10种 D.16种
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:选择题
在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法正确的是
CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法正确的是

A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有V正<V逆
C.反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH<0
CO2(g)+H2(g)的ΔH<0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:填空题
某大学实验室对煤矸石(主要含Al2O3、SiO2及Fe2O3)制备聚合氯化铝{[Al2(OH)nCl6-n]m(1≤n≤5,m≤10),简称PAC,是一种新型、高效的絮凝剂和净水剂}。其工艺流程如下:
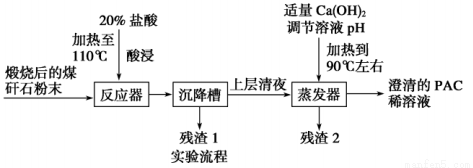
请回答下列问题:
(1)用浓盐酸配制20%的盐酸所需的玻璃仪器有______________________________。
(2)加20%的盐酸酸浸,有关反应的离子方程式为_____________________________。
(3)残渣2的主要成分是,设计实验证明你的结论(填操作、现象):_____________________。
(4)由澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是_________________,得到的PAC粗产品中可能含有的杂质离子是____________。
(5)从不引入杂质的角度来考虑,调节溶液pH的试剂可改为________(填字母)。
A.NaOH B.Al C.氨水 D.Al2O3
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:推断题
A、B和C为短周期非金属元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等。回答下列问题:
(1)A、B和C分别为__________、____________、_____________(用元素名称表示)。
(2)由以上元素组成的化合物中,属于离子化合物的是___________,属于共价化合物的是_________。(各写一种即可)
(3)B的常见气态氢化物的电子式为_______________,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有____________(填化学键的种类),该离子氯化物的水溶液呈__________性,用离子方程式表示为_______________________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:选择题
下列事实中,能说明B(OH)2是弱碱的是( )
A.等体积的0.010mol/LB(OH)2溶液与0.010mol/LH2SO4溶液恰好完全反应
B.0.010mol/LB(OH)2溶液能使红色石蕊试液变蓝
C.0.010mol/LBCl2溶液呈酸性,0.010mol/LB2CO3溶液呈中性
D.0.010mol/LB(OH)2溶液能够与NH4Cl反应生成NH3(g)
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1.6gNH2-和1.5g—CH3含有的电子数均为NA
B.标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为0.1NA
C.氢氧化钠溶于与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA
D.12gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种元素.其相关信息如下:

请回答下列问题。
(1)写出E元素原子基态时M层的电子排布式_____________;
(2)C元素单质分子中含有δ和π键的键数之比为_____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:_____________ ;C2A4分子中C原子轨道的杂化类型是_____________;
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有_____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为_____________(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5) 三硫化四磷是黄绿色针状结晶,其结构如图所示。三硫化四磷分子中P原子采取_____________杂化,与PO3-互为等电子体的化合物分子的化学式为_____________,用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com