
����Ŀ��2019��ŵ������ѧ����������ӵ������LiFePO4(���������) ������ӵ�ص�һ�ֵ缫���ϣ���ͨ�����з����Ʊ���
����һ��2FePO4(s)+Li2 CO3(s)+2C(s)2LiFePO4(s)+3CO(g)
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ_____�������ݻ�����������У�������Ӧ�ﵽƽ��ʱ��һ����̼��Ũ��ΪamolL��1���ٳ���bmolһ����̼����ƽ����_____�����ƶ����ﵽ��ƽ��ʱ��һ����̼��Ũ��Ϊ_____��
(2)һ���¶��£���2L�ܱ������з���������Ӧ����Ӧ���е�20minʱ�������ڹ��������������5.6g����0��20min��һ����̼��ƽ����Ӧ������_____��
��������LiFePO4����ͨ��(NH4)2Fe(SO4)2��H3PO4��Li OH��Һ������������Ӧ�����ó�����80����ո�����³��Ͷ��Ƶá�
(3)�������Ƽ��Ա�������﮼���ǿ������Ԫ��������֪ʶ˵������_____��
(4)��������ӦͶ��ʱ������(NH4)2Fe(SO4)2��LiOH��Һֱ�ӻ�ϣ���ԭ����_____��
(5)��������﮵���ܷ�ӦΪ��FePO4+Li![]() LiFePO4���ŵ�ʱ������Ϊ_____(��д��ѧʽ)�����øõ�ص�ⱥ��ʳ��ˮ(���ص缫��Ϊ���Ե缫)����������������4480mL����(��״��)����ʱ���õ������﮵�����Ϊ_____��
LiFePO4���ŵ�ʱ������Ϊ_____(��д��ѧʽ)�����øõ�ص�ⱥ��ʳ��ˮ(���ص缫��Ϊ���Ե缫)����������������4480mL����(��״��)����ʱ���õ������﮵�����Ϊ_____��
���𰸡�K��c3(CO) �� amolL��1 0.005mol/(Lmin) ͬһ���壬���ϵ��£�Ԫ������������Ӧ��ˮ�����������ǿ ��ֹ�γɸ��ױ�����������������(�����������ڼ��������¸��ױ�����) Li 1.4g
��������
(1)����ʽ��ֻ��COΪ���壬ƽ�ⳣ��ΪCOŨ�ȵ����η���COŨ������ƽ�������ƶ�����Ϊƽ�ⳣ���������¶ȵĺ������¶Ȳ��䣬ƽ�ⳣ�����䣬�ʴﵽƽ��ʱ��COŨ�Ȳ��䣻
(2)��Ӧ���е�20minʱ�������ڹ��������������5.6g��˵������5.6gCO���ɼ���CO�����ʵ���Ũ�ȣ��������㷴Ӧ���ʣ�
(3)Ԫ�صĽ�����Խǿ����Ӧ������������ˮ����ļ���Խǿ��
(4)(NH4)2Fe(SO4)2��LiOH��Һֱ�ӻ�ϣ��������������������������������ȶ���
(5)��طŵ�ʱԭ���ԭ����Liʧ���ӷ���������Ӧ��ԭ��ظ�����FePO4�������õ����ӷ�����ԭ��Ӧ����LiFePO4����ϸ��ݵ�ⱥ��ʳ��ˮ����ʽ���м������ת�ƣ����ݵ����غ�͵缫��Ӧ��������﮵�������
(1)����ʽ��ֻ��COΪ���壬��K��c3(CO)��COŨ������ƽ�������ƶ����������¶Ȳ��䣬��ƽ�ⳣ�����䣬�ʴﵽƽ��ʱ��COŨ�Ȳ��䣬��ΪamolL��1���ʴ�Ϊ��K��c3(CO)���棻amolL��1��
(2)��Ӧ���е�20minʱ�������ڹ��������������5.6g��˵��������5.6gCO����c(CO)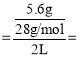 0.1mol/L��
0.1mol/L��![]() 0.005mol/(Lmin)���ʴ�Ϊ��0.005mol/(Lmin)��
0.005mol/(Lmin)���ʴ�Ϊ��0.005mol/(Lmin)��
(3)Li�����ڱ���λ��ͬһ�����Ԫ��Na���Ϸ��������ϵ��£�Ԫ�صĽ�������ǿ��Ԫ�صĽ�����Խǿ����Ӧ������������ˮ����ļ��Ծ�Խǿ�����������Ƽ��Ա�������﮼���ǿ���ʴ�Ϊ��ͬһ���壬���ϵ��£�Ԫ������������Ӧ��ˮ�����������ǿ��
(4)(NH4)2Fe(SO4)2��LiOH��Һֱ�ӻ�ϣ��������������������������������ȶ����ױ����������������������ʴ�Ϊ����ֹ�γɸ��ױ�����������������(�����������ڼ��������¸��ױ�����)��
(5)��طŵ�ʱ��Liʧ���ӷ���������Ӧ������Ϊԭ��ظ��������øõ�ص�ⱥ��ʳ��ˮ(���ص缫��Ϊ���Ե缫)  ����������������4480mL����(��״��)����ʱ���������ʵ���Ϊ0.2mol�������������������ʵ�����0.1mol������ݹ�ϵʽ
����������������4480mL����(��״��)����ʱ���������ʵ���Ϊ0.2mol�������������������ʵ�����0.1mol������ݹ�ϵʽ![]() ��֪������﮵�����Ϊ0.2mol��7g/mol��1.4g���ʴ�Ϊ��Li��1.4g��
��֪������﮵�����Ϊ0.2mol��7g/mol��1.4g���ʴ�Ϊ��Li��1.4g��


 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ����Һ�п��ܴ��ڴ���Ag+��Mg2+��Fe3+��Cu2+�е�һ�ֻ��֣�����д���пհס�
(1)�������κ�ʵ��Ϳ��Կ϶���Һ�в����ڵ�������________________��
(2)ȡ����ԭ��Һ���������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��������ʧ��˵��ԭ��Һ�п϶����ڵ�������_______,�йط�Ӧ�����ӷ���ʽΪ___________��
(3)ȡ(2)����Һ�ӹ�����NaOH��Һ�����ְ�ɫ������˵��ԭ��Һ�п϶���________���йط�Ӧ�����ӷ���ʽΪ_________________________��
(4)ԭ��Һ�п��ܴ������ڵ���������________(�����)��
A.Cl- B.NO3- C. CO32- D.OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Ӧ2A(g)![]() B(g)����H��0���ܱ������дﵽƽ�⣬ƽ���c(A)/c(B)��a�����ı�ijһ�������㹻ʱ���Ӧ�ٴδﵽƽ��״̬����ʱc(A)/c(B)��b������������ȷ��
B(g)����H��0���ܱ������дﵽƽ�⣬ƽ���c(A)/c(B)��a�����ı�ijһ�������㹻ʱ���Ӧ�ٴδﵽƽ��״̬����ʱc(A)/c(B)��b������������ȷ��
A.�ڸ��¶��£������ݻ��̶����䣬�������ڲ�����B���壬��a��b
B.�ڸ��¶Ⱥ�ѹ�������ٳ�������B���壬��a��b
C.�������������䣬�����¶ȣ���a��b
D.�������¶ȡ�ѹǿ���䣬����������壬��a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݴ����ᴿ��ԭ������ȥ�Ȼ�����Һ���������Ȼ�þ������þ�����ʣ���ѡ������������Һ��ϡ�����̼�����Һ�����Լ�������ͼ���������
![]()
(1)A�Ļ�ѧʽ��__________��B�Ļ�ѧʽ��________��C�Ļ�ѧʽ��__________��
(2)�������A��Ŀ����__________________��
(3)�������B��Ŀ����____________________��
(4)������е�Ŀ����________________________��
(5)�������������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ϣ�������Ca2++![]() �TCaCO3����ʾ����(����)
�TCaCO3����ʾ����(����)
A.Ca(OH)2��Na2CO3B.CaCl2��K2CO3
C.CaCl2��Na2CO3D.Ca(OH)2��(NH4)2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ�����ͭ���Ƚ���������������ͼ1��
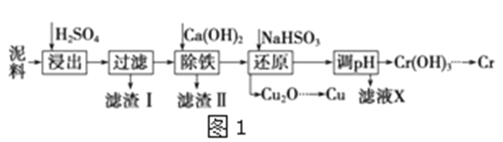
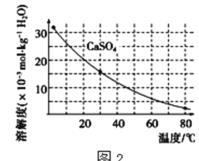
��֪�������ʳ�����pH��CaSO4���ܽ��������ͼ2��
Fe3+ | Cu2+ | Cr3+ | |
��ʼ����pH | 2.1 | 4.7 | 4.3 |
��ȫ����pH | 3.2 | 6.7 | a |
(1)�ڽ��������г�������Fe2(SO4)3��Cr2(SO4)3�⣬��Ҫ����__��
(2)�ڳ��������У���Ҫ��ȥFe3+��CaSO4���������ز�����������ʯ�������pH��Լ__������Fe3+�Ѿ������IJ�����__��������Һ�ӵ�80����__��
(3)д����ԭ�����м���NaHSO3����Cu2O���巴Ӧ�����ӷ���ʽ__���˲����м���NaHSO3�õ�Cu2O�IJ���Ϊ95%����NaHSO3�����������˷��Լ��⣬������ֵ�������__��
(4)��FeS������Һ�д��ڣ�FeS(s)![]() Fe2+(aq)+S2-(aq)��������FeS��Ksp=6.25��10-18����֪FeS������Һ��c(H+)��c(S2-)֮���������������ϵ��c2(H+)c(S2-)=1.0��10-22��Ϊ��ʹ��Һ��c(Fe2+)�ﵽ1molL-1���ֽ�����FeSͶ���䱥����Һ�У�Ӧ������Һ�е�c(H+)Ϊ___��
Fe2+(aq)+S2-(aq)��������FeS��Ksp=6.25��10-18����֪FeS������Һ��c(H+)��c(S2-)֮���������������ϵ��c2(H+)c(S2-)=1.0��10-22��Ϊ��ʹ��Һ��c(Fe2+)�ﵽ1molL-1���ֽ�����FeSͶ���䱥����Һ�У�Ӧ������Һ�е�c(H+)Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O3Ҳ��һ�ֺܺõ������������и�Ч���ྻ�����㡢���õ��ŵ㡣O3������ˮ����ˮ���ֽ⣬������[O]Ϊ������ԭ�ӣ��к�ǿ��ɱ���������������³�ѹ�·�����Ӧ���£���Ӧ��O3![]() O2��[O]��H��0ƽ�ⳣ��ΪK1����Ӧ��[O]��O3
O2��[O]��H��0ƽ�ⳣ��ΪK1����Ӧ��[O]��O3![]() 2O2��H��0ƽ�ⳣ��ΪK2���ܷ�Ӧ��2O3
2O2��H��0ƽ�ⳣ��ΪK2���ܷ�Ӧ��2O3![]() 3O2��H��0�ⳣ��ΪK������������ȷ����(����)
3O2��H��0�ⳣ��ΪK������������ȷ����(����)
A.�����¶ȣ�K����B.K��K1��K2
C.�ʵ����£����������Ч��D.ѹǿ����K2��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ�������й�������ȷ����
A.1mol�Ҵ���������������ȩ��ת�Ƶĵ�����Ϊ4NA
B.30g��14C2H2��C18O��ɵĻ�������к��е�������Ϊ14NA
C.��״���£�44.8LSO2������O2��Ӧ���ɵ�SO3������Ϊ2NA
D.��״���£�2.24LCl2�����ϡNaOH��Һ��Ӧ��ת�Ƶĵ�������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�������������������100 mL 1.7mol/L��NaOH��Һ��ȫ���ա������պ����Һ���з������飬��֪c(OH-)=0.1mol/L (�����Ƿ�Ӧǰ����Һ������仯) ��ClO����ClO3�������ʵ���Ũ��֮��Ϊ5��1����ش�
��1�������������ĵ�NaOH�����ʵ���Ϊ_______________mol��
��2�������������������ʵ���Ϊ_______________mol������ԭ�����������ʵ���Ϊ _______________mol��
��3�������ö������̺�Ũ���Ṳ�ȵķ������������Ʊ�β���е����������ĵĶ������̵�����Ϊ_______________g��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com