
【题目】写出下列反应的化学反应方程式,并判断其反应类型.
①乙烯和水反应: , 属于反应;
②由苯制取溴苯: , 属于反应.
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】常温下将浓度为0.1mol/L的盐酸逐滴加入到20mL 0.1mol/L一元碱MOH溶液中,溶液的pH随盐酸体积的变化如图所示。下列说法正确的是
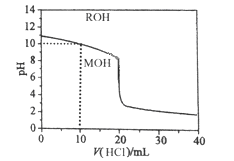
A. pH=10时,c(Cl-)>c(M+)>c(OH-)>c(H+)
B. V(HCl)=20mL,MOH与盐酸反应后的溶液显酸性
C. 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内的含量虽然很少,但在维持正常生命活动中不可缺少。这种说法可通过下面的哪一实例得到证实( )
A.植物缺镁时叶片变黄
B.油菜缺硼时只开花不结果
C.动物血液中钙盐的含量太低,容易发生抽搐
D.缺磷时会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是___________。
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________。从该溶液中尽可能多地析出KClO3 固体的方法是______________。
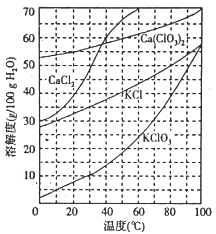
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的角度看,断开化学键要__________,形成化学键要_______。化学反应是释放能量还是吸收能量取决于__________,当反应物的总能量高于生成物时,该反应为_____反应;当反应物的总能量低于生成物时,该反应为_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为周期表中短周期的一部分.已知a原子的最外层上的电子数目是次外层电子数目的一半,下列说法中不正确的是( ) ![]()
A.元素a的最高价氧化物的水化物的酸性比b弱
B.元素a的原子半径比d的大
C.元素a的单质在空气中燃烧会导致“温室效应”
D.元素a单质是一种良好的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A的结构简式如下图所示,下列有关此物质的说法正确的是( )
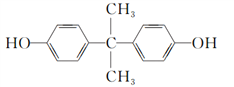
A. 1 mol该物质与足量溴水反应消耗2 mol Br2
B. 该物质能与碳酸氢钠溶液反应放出CO2
C. 该物质的所有碳原子可能在同一平面
D. 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以![]() 存在)转变成重要的工业原料
存在)转变成重要的工业原料![]() (反应条件略)
(反应条件略)

活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是___________________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择(________)(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是________________。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com