
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
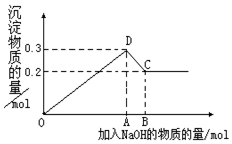 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶头滴管伸入量筒内滴加液体 | |
| B. | 用酒精灯的外焰给盛有液体(液体体积约占试管体积的$\frac{1}{4}$)的试管加热 | |
| C. | 称量完药品后,将药匙内剩余的药品放回试剂瓶 | |
| D. | 过滤时漏斗的末端在烧杯的中央 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O和C2H4 | B. | C6H12O2和C5H12O | C. | C2H6O和C3H6O2 | D. | CH4和C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Z)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 若使用催化剂,则反应速率和X的转化率均增大 | |
| B. | 其他条件不变,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,则△H>0 | |
| C. | 其他条件不变,容器体积压缩到1.0 L,平衡常数将增大 | |
| D. | 温度不变,向容器中再充入2 mol X、1 mol Y,反应达到新平衡时 $\frac{n(Z)}{n(Y)}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 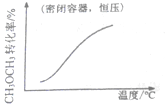 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g):△H>0 | B. | 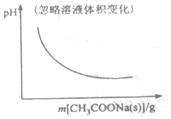 CH3COOH?H++CH3COO- | ||
| C. | 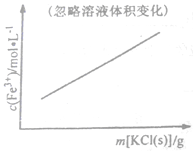 FeCl3+3KSCN?Fe(SCN)3+3KCl | D. | 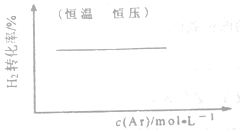 N2(g)+3H2(g)?2NH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com