
 ,写出制取过程的化学方程式.
,写出制取过程的化学方程式. +Br2
+Br2| Fe |
 -Br+HBr;
-Br+HBr;| 一定条件 |
 -Br+CH2=CHBr+2Na
-Br+CH2=CHBr+2Na| 一定条件 |
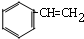 +2NaBr,
+2NaBr, +Br2
+Br2| Fe |
 -Br+HBr;
-Br+HBr;| 一定条件 |
 -Br+CH2=CHBr+2Na
-Br+CH2=CHBr+2Na| 一定条件 |
 +2NaBr.
+2NaBr.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Cu2++2OH-=Cu(OH)2↓→CuCO3+2NaOH=Cu(OH)2↓+Na2CO3 | ||
B、C
| ||
C、Ca2++C
| ||
| D、H++OH-=H2O→2NH3?H2O+H2SO4=(NH4)2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 混合物 | 氧化物 | 碱 | 盐 |
| A | Na2CO3?10H2O | 生石灰 | 纯碱 | 苏打 |
| B | 漂白粉 | 水 | 烧碱 | 纯碱 |
| C | 碘酒 | 氧化钠 | 碱式碳酸铜 | 氯化铁 |
| D | 粗盐 | 熟石灰 | 苛性钠 | 胆矾 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.02 | 0.00 | 16.69 | 16.69 | 0.1042 |
| 2 | 16.71 | 0.00 | 17.90 | 17.90 | |
| 3 | 19.52 | 0.00 | 20.79 | 20.79 | 0.1065 |
| 4 | 14.99 | 0.00 | 16.02 | 16.02 | 0.1069 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com