
ЁОЬтФПЁПФГШШЕчГЇгУЭбСђЕУЕНЕФЪЏИрЃЈCaSO42H2OЃЉЩњВњK2SO4ЗЪСЯЕФСїГЬШчЭМЃК

ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЪЏИржаSЕФЛЏКЯМлЪЧ___ЃЌЪдЛГіS2-ЕФРызгНсЙЙЪОвтЭМ___ЃЌЧыаДГіЭбСђЙ§ГЬЕФЛЏбЇЗНГЬЪН2CaCO3+2SO2+O2+4H2OЃН2CaSO42H2O+2__ЁЃ
ЃЈ2ЃЉЪЏИргыБЅКЭЃЈNH4ЃЉ2CO3ШмвКЯрЛьКЯЃЌЗЂЩњЗДгІЂёЪБашВЛЖЯНСАшЃЌЦфФПЕФЪЧ__ЁЃ
ЃЈ3ЃЉЪЕбщЪвЭъГЩЙ§ТЫВйзїЫљашвЊгУЕНВЃСЇАєЃЌВЃСЇАєЕФзїгУЪЧ____ЁЃ
ЃЈ4ЃЉИУЙЄвеПЩвдбЛЗРћгУЕФЮяжЪга____ЃЌИБВњЦЗNH4ClХЉвЕЩњВњжаПЩгУзї___ЁЃ
ЁОД№АИЁП+6 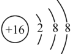 CO2 ЪЙдСЯГфЗжЗДгІЃЌЬсИпдСЯРћгУТЪ в§Сї ЬМЫсИЦ ЕЊЗЪ
CO2 ЪЙдСЯГфЗжЗДгІЃЌЬсИпдСЯРћгУТЪ в§Сї ЬМЫсИЦ ЕЊЗЪ
ЁОНтЮіЁП
(1)ИљОне§ИКЛЏКЯМлЕФДњЪ§КЭЮЊ0МЦЫуSЕФЛЏКЯМлЃЛS2-ЕФКЫЕчКЩЪ§ЮЊ16ЃЌКЫЭтКЌга18ИіЕчзгЃЌНсКЯКЫЭтЕчзгЕФХХВМЙцТЩЛГіРызгНсЙЙЪОвтЭМЃЛИљОнжЪСПЪиКуЖЈТЩЗжЮіХаЖЯЃЛ
(2)ИљОнНСАшФмЙЛЪЙдСЯГЩЗжЛьКЯЗжЮіЃЛ
(3)ИљОнЙ§ТЫВйзїжаВЃСЇАєЕФзїгУЗжЮіЃЛ
(4)ИљОнЗДгІЙ§ГЬжаЕФЗДгІЮяЁЂЩњГЩЮяЃЌевГіФмбЛЗРћгУЕФЮяжЪЃЌИљОнNH4ClКЌгаNдЊЫиЗжЮіЁЃ
(1)ЪЏИр(CaSO42H2O)жаCaЕФЛЏКЯМлЮЊ+2МлЃЌHЕФЛЏКЯМлЮЊ+1МлЃЌOЕФЛЏКЯМлЮЊ-2МлЃЌИљОне§ИКЛЏКЯМлЕФДњЪ§КЭЮЊ0ЃЌSЕФЛЏКЯМлЪЧ+6МлЃЌS2-ЕФКЫЕчКЩЪ§ЮЊ16ЃЌКЫЭтКЌга18ИіЕчзгЃЌРызгНсЙЙЪОвтЭМЮЊ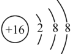 ЃЛгЩжЪСПЪиКуЖЈТЩЃЌЗДгІЧАКѓдзгЕФжжРрМАЪ§ФПВЛБфПЩжЊЃЌЫљвдЩњГЩЮяжагІЬюШыЕФЮяжЪЪЧЃКCO2ЃЛЙЪД№АИЮЊЃК+6ЃЛ
ЃЛгЩжЪСПЪиКуЖЈТЩЃЌЗДгІЧАКѓдзгЕФжжРрМАЪ§ФПВЛБфПЩжЊЃЌЫљвдЩњГЩЮяжагІЬюШыЕФЮяжЪЪЧЃКCO2ЃЛЙЪД№АИЮЊЃК+6ЃЛ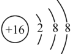 ЃЛCO2ЃЛ
ЃЛCO2ЃЛ
(2)ЪЏИргыБЅКЭ(NH4)2CO3ШмвКЯрЛьКЯЃЌЗЂЩњЗДгІЂёЪБашВЛЖЯНСАшЃЌПЩвдЪЙдСЯГфЗжЗДгІЃЌЬсИпдСЯРћгУТЪЃЌЙЪД№АИЮЊЃКЪЙдСЯГфЗжЗДгІЃЌЬсИпдСЯРћгУТЪЃЛ
(3)ЪЕбщЪвЭъГЩЙ§ТЫВйзїашвЊгУВЃСЇАєв§СїЃЌЗРжЙвКЬхСїЕНТЉЖЗЭтЃЌЙЪД№АИЮЊЃКв§СїЃЛ
(4)ЭЈЙ§ЗжЮіЗДгІЕФСїГЬПЩжЊЃЌИУЙЄвеПЩвдбЛЗРћгУЕФЮяжЪЪЧЬМЫсИЦЃЛNH4ClЪЧГЃМћЕФвЛжжЕЊЗЪЃЌЙЪД№АИЮЊЃКЬМЫсИЦЃЛЕЊЗЪЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТСЊАБ(N2H4)ЕФЫЎШмвКжагаЃК
Ђй N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
Ђк N2H5++H2O![]() N2H62++OH- K2 ЃЌ
N2H62++OH- K2 ЃЌ
ИУШмвКжаЕФЮЂСЃЕФЮяжЪЕФСПЗжЪ§ІФ(X)Ыц-lgc(OH-)БфЛЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧ

A. ЭМжаЂѓЖдгІЕФЮЂСЃЮЊN2H62+
B. ЗДгІЂкЮЊN2H5+ЕФЫЎНтЦНКтЗНГЬЪН
C. ШєCЕуЮЊN2H5C1ШмвКЃЌдђДцдкЃКc(Cl-)>c(N2H5+ )+2c(N2H62+)
D. ОнAЕуПЩЧѓЃКK1=10-6
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮяжЪЕФЗжРрШчЭМЫљЪОЃК

гЩЭМХаЖЯЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.МзЭМЫљЪОЕФЗжРрЗНЗЈЪєгкЪїзДЗжРрЗЈ
B.ввЭМЫљЪОЕФЗжРрЗНЗЈЪєгкНЛВцЗжРрЗЈ
C.МюадбѕЛЏЮявЛЖЈЪЧН№ЪєбѕЛЏЮя
D.ЗЧН№ЪєбѕЛЏЮявЛ ЖЈЪЧЫсадбѕЛЏЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПН№ЪєМгЙЄЧАГЃгУбЮЫсЖдН№ЪєБэУцбѕЛЏЮяНјааЧхЯДЃЌЛсВњЩњЫсЯДЗЯЫЎЁЃpHдк2зѓгвЕФФГЫсадЗЯЫЎКЌЬњдЊЫижЪСПЗжЪ§дМ3%ЃЌЦфЫћН№ЪєдЊЫиШчЭЁЂФјЁЂаПХЈЖШНЯЕЭЃЌзлКЯРћгУЫсЯДЗЯЫЎПЩжЦБИШ§ТШЛЏЬњЁЃжЦБИЙ§ГЬШчЯТЃК

ЯрЙиН№ЪєРызгЩњГЩЧтбѕЛЏЮяГСЕэЕФpHШчЯТБэЃК
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | |
ПЊЪМГСЕэЕФpH | 1.5 | 4.2 | 7.1 | 5.4 |
ГСЕэЭъШЋЕФpH | 3.7 | 6.7 | 9.2 | 8.0 |
ЛиД№ЯТСаЮЪЬтЃК
(1)ЁАжаКЭЁБЪБЕїНкpHжС________ЃЌгаРћгкКѓајжЦБИЕУДПЖШНЯИпЕФВњЦЗЁЃ
(2)ДІРэЫсЯДЗЯЫЎжаКЭКѓЕФТЫдќЃЌЪЙЬњдЊЫиНўГіЁЃАДееВЛЭЌЕФЙЬвКБШЭЖШыЁАЙ§ТЫЁБКѓТЫдќКЭЙЄвЕбЮЫсНјааЗДгІЕФЬњНўГіТЪШчЭМЫљЪОЃЌЪЕМЪЩњВњжаЙЬвКБШбЁдё1.5ЁУ1ЕФдвђЪЧ__________________ЁЃ

(3)аДГіЁАбѕЛЏЁБжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК____________________________________ЁЃ
(4)ЁАЫсШмЁБКѓашИљОнШмвКжаFe2ЃЋКЌСПШЗЖЈбѕЛЏМСЕФЭЖШыСПЁЃгУK2Cr2O7БъзМШмвКВтЖЈFe2ЃЋ(Cr2O![]() БЛЛЙдЮЊCr3ЃЋ)ЕФКЌСПЃЌИУЗДгІРызгЗНГЬЪНЮЊ____________________________ЁЃ
БЛЛЙдЮЊCr3ЃЋ)ЕФКЌСПЃЌИУЗДгІРызгЗНГЬЪНЮЊ____________________________ЁЃ
(5) НЋШ§ТШЛЏЬњШмвКдквЛЖЈЬѕМўЯТ________ЁЂ________ЁЂЙ§ТЫЁЂЯДЕгЁЂдкТШЛЏЧтЦјЗежаИЩдяЕУFeCl3ЁЄ6H2OОЇЬхЃЌдкЪЕбщЪвЙ§ТЫзАжУжаЯДЕгЙЬЬхЕФЗНЗЈЪЧ___________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
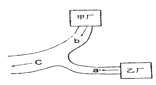
ЁОЬтФПЁППЩНЕНтОлКЯЮяPЕФКЯГЩТЗЯпШчЯТ

ЃЈ1ЃЉAЕФКЌбѕЙйФмЭХУћГЦЪЧ____________ЁЃ
ЃЈ2ЃЉєШЫсaЕФЕчРыЗНГЬЪЧ________________ЁЃ
ЃЈ3ЃЉBЁњCЕФЛЏбЇЗНГЬЪНЪЧ_____________ЁЃ
ЃЈ4ЃЉЛЏКЯЮяDБНЛЗЩЯЕФвЛТШДњЮяга2жжЃЌDЕФНсЙЙМђЪНЪЧ___________ЁЃ
ЃЈ5ЃЉEЁњFжаЗДгІЂйКЭЂкЕФЗДгІРраЭЗжБ№ЪЧ___________ЁЃ
ЃЈ6ЃЉFЕФНсЙЙМђЪНЪЧ_____________ЁЃ
ЃЈ7ЃЉОлКЯЮяPЕФНсЙЙМђЪНЪЧ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзЁЂввСНИіЛЏЙЄГЇЗжВМдкШчЭМЫљЪОЮЛжУЃЌМ§ЭЗЫљжИЮЊЙЄГЇХХЫЎЧўжаЫЎСїЗНЯђЁЃШчЙћaДІШЁЕУЕФЫЎбљОбщВтжЛКЌЩйСПЯѕЫсКЭЯѕЫсБЕЃЌдкcШыШЁЕУЕФЫЎбљОМьВтpH=7ЃЌЧвжЛКЌЩйСПЯѕЫсФЦЃЌдђbДІЕФЫЎжаКЌгаЕФЮяжЪгІЪЧЯТСаЮяжЪжаЕФ
A. MgSO4ЁЂNaCl
B. K2SO4ЁЂNaOH
C. KOHЁЂNa2SO4
D. NaOHЁЂNa2SO4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШмвКжаЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕе§ШЗЕФЪЧ
A. 25ЁцЪБЃЌЯђ0.1molЁЄL-1NH4HSO4ШмвКжаЕЮМгNaOHШмвКжСжаадЃКcЃЈNa+ЃЉЃОc(NH4+)ЃОc(SO42-)ЃОc(OH-)=c(H+)
B. 25ЁцЪБЃЌNaBШмвКЕФpH=8ЃЌcЃЈNa+ЃЉ- cЃЈB-ЃЉ=9.9ЁС10-7 molЁЄL-1
C. 0.1 molЁЄL-1NaHCO3ШмвКЃКcЃЈNa+ЃЉЃОc(oH-)ЃОc(HCO3-)ЃОc(H+)
D. ЯрЭЌЮяжЪЕФСПХЈЖШЕФCH3COONaКЭNaClOЕФЛьКЯвКжаЃЌИїРызгХЈЖШЕФДѓаЁЙиЯЕЪЧЃКcЃЈNa+ЃЉЃОc(ClO-)ЃОc(CH3COO-)ЃОc(OH-)ЃОc(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЪБЃЌНЋa1 mL b1 molЁЄL-1 HClМгШыЕНa2 mL b2 molЁЄL-1 NH3ЁЄH2OжаЃЌЯТСаНсТле§ШЗЕФЪЧ
A. ШєЛьКЯвКЕФpH<7ЃЌдђ:a1b1=a2b2
B. Шєa1=a2ЧвЛьКЯвКЕФpH>7ЃЌдђb1<b2
C. Шєa1=a2ЁЂb1=b2ЃЌдђЛьКЯШмвКжа: ![]()
D. ШєЛьКЯКѓШмвКpH=7ЃЌдђЛьКЯШмвКжа: ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗњРћАКЪЧБЅКЭЬМЧтЛЏКЯЮяЕФТБзхбмЩњЮяЕФзмГЦЃЌЦфЦЦЛЕГєбѕВуЕФЛЏбЇЗДгІЛњРэШчЯТЃЈвдЖўТШЖўЗњМзЭщЮЊР§ЃЌЖўТШЖўЗњМзЭщПЩгЩЫФТШЛЏЬМгыЗњЛЏЧтдкДпЛЏМСДцдкЯТЁЂПижЦЛиСїРфФ§ЮТЖШЮЊЉ5ЁцЪБЕУЕНЃЉЃК
ЂйCF2Cl2![]() CF2Cl+Cl
CF2Cl+Cl
ЂкCl+O3ЁњClO+O2
ЂлClO+ClOЁњClOOClЃЈЙ§бѕЛЏТШЃЉ
ЂмClOOCl![]() 2Cl+O2
2Cl+O2
ЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧ
A. зЯЭтЯпЪЙCF2Cl2ЗжНтВњЩњЕФЪЧГєбѕЩњГЩбѕЦјЕФДпЛЏМС
B. ЗДгІЂлжаЕФТШзггыЗДгІЂмжаЩњГЩЕФТШдзгЛЏбЇаджЪЯрЭЌ
C. ClOOClЗжзгжаИїдзгзюЭтВуОљДяЕН8ЕчзгЮШЖЈНYЙЙ
D. ЦјЬЌЧтЛЏЮяЕФЮШЖЈадЃКHFЃОH2OЃОHCl
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com