
| A. | 加成反应 | B. | 聚合反应 | C. | 氧化反应 | D. | 水解反应 |
科目:高中化学 来源: 题型:选择题
| A. | 充电时,电解质溶液中K+向阳极移动 | |
| B. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| C. | 放电时,负极反应为:Zn+4OH--2e-═Zn(OH)42- | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3-→ +2HCO3-→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去甲酸乙酯中甲酸和乙醇,加入饱和纯碱溶液,振荡静置后分液 | |
| B. | 除去蛋白质溶液中氨基酸,加Na0H溶液后分液 | |
| C. | 分离高级脂肪酸钠和甘油,加水后分液 | |
| D. | 除去甲苯中的苯酚,加入过量浓溴水后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

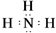 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式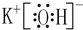 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com