
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烷的结构式:C2H6 | ||
| C. | 苯的分子式: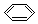 | D. |  --甲基的电子式. --甲基的电子式. |
分析 A.乙烯分子中含有碳碳双键,该结构简式中漏掉了碳碳双键;
B.结构式中需要用“-”表示出所有的化学键;
C.分子式中只表示出原子种类及数目即可;
D.甲基为中性原子团,其化学式中含有3个碳氢键,碳原子最外层电子数为7.
解答 解:A.乙烯分子中含有官能团碳碳双键,乙烯正确的结构简式为:CH2=CH2,故A错误;
B.C2H6为乙烷的分子式,乙烷正确的结构式为: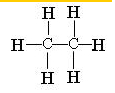 ,故B错误;
,故B错误;
C. 为苯的结构简式,苯的分子式为:C6H6,故C错误;
为苯的结构简式,苯的分子式为:C6H6,故C错误;
D.甲基中含有3个C-H键,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、结构式、分子式等知识,明确常见化学用语的书写原则为解答关键是,试题培养了学生的规范答题能力.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(B2)=0.9 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
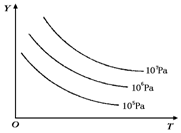 有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )
有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )| A. | G的转化率 | B. | 平衡混合气中R的体积分数 | ||
| C. | 平衡混合气中G的体积分数 | D. | 平衡混合气中L的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- | |
| B. | 向无色溶液加入盐酸有气体产生,结论:溶液中有CO32- | |
| C. | 向无色试液加入硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- | |
| D. | 向某溶液中加入氢氧化钠溶液加热,有氨气生成,结论:溶液中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3kJ.mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ.mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol | |
| C. | NaOH和HCl反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{550℃,30Mpa}^{催化剂}$2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
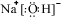 ,并指出其中存在的化学键.离子键和共价键
,并指出其中存在的化学键.离子键和共价键查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com