
| A. | 1:1 | B. | 1:2 | C. | 1:4 | D. | 1:5 |
分析 根据质量守恒定律知,12gA加热完全分解产生B和C,其中B的质量为2g,则生成C的质量=(12-2)g=10g,同时C又能部分分解产生0.1gD和7.9gE,则剩余C的质量=(10-0.1-7.9)g=2g,据此分析解答,.
解答 解:根据质量守恒定律知,12gA加热完全分解产生B和C,其中B的质量为2g,则生成C的质量=(12-2)g=10g,同时C又能部分分解产生0.1gD和7.9gE,则剩余C的质量=(10-0.1-7.9)g=2g,所以最终该密闭容器中B和C的质量比=2g:2g=1:1,故选A.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确质量守恒定律是解本题关键,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 人类目前所利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 我国目前最主要的能源是石油 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

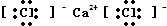 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离碘单质和四氯化碳的混合物需要烧杯、玻璃棒和漏斗 | |
| B. | 用湿润的pH试纸测定溶液的pH一定会产生误差 | |
| C. | 实验室可以向浓硫酸中滴加浓盐酸制取少量氯化氢 | |
| D. | 用浓氨水可以除去试管内壁银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加和单质生成的化学反应一定是氧化还原反应 | |
| B. | 盐酸是强酸,所以盐酸是强电解质 | |
| C. | 向FeCl3饱和溶液滴加NaOH溶液可制备Fe(OH)3胶体 | |
| D. | 化合反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
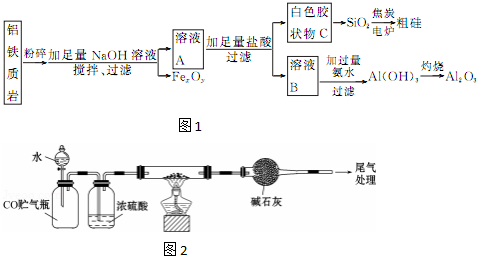
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中水是分散质 | |
| D. | 将所得分散系过滤,在滤纸上能得到分散质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com