
某同学组装如图所示电化学装置,电极I为Zn,其它电极均为Cu。下列说法错误的是
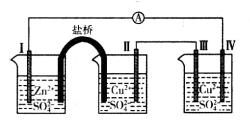
A.电极I发生氧化反应
B.相同的时间内,电极Ⅱ与Ⅳ质量变化相同
C.电极III的电极反应:4OH――4e-=2H2O+O2↑
D.电流方向:电极Ⅳ→ →电极I
→电极I
C
【解析】
试题分析:电极Ⅰ为Al,其它电极均为Cu,Al是活泼的金属易失电子作负极,及打击Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极。则 A、电极Ⅰ是负极,电极反应式为Al-3e-=Al3+,发生氧化反应,A正确;B、电极Ⅱ是正极,正极上发生反应为Cu 2++2e-=Cu,电极Ⅱ质量逐渐增大。电极Ⅳ是阴极,溶液中的铜离子放电,电极反应式为Cu 2++2e-=Cu,电极Ⅱ质量逐渐增大。根据电子转移守恒可知,电极Ⅱ与Ⅳ质量变化相同,B正确;C、电极Ⅲ为阳极,电极反应式为Cu-2e-=Cu 2+,C错误;D、原电池中电流从正极沿导线流向负极,即电极Ⅳ→ →电极Ⅰ,D正确,答案选C。
→电极Ⅰ,D正确,答案选C。
考点:考查电化学原理的应用


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值。下列说法正确的是
A.2mol·L-1的AlCl3溶液中含Cl-数为6nA
B.常温常压下,14g氮气含有的核外电子数为7nA
C.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为nA
D.高温高压下,28gN2与6gH2反应,生成的NH3分子数为2nA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:实验题
(16分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上可用铁质容器盛放冷的浓硫酸,其原因是 。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的离子反应方程式为: ,检验是否有Fe2+应选用下列 (选填序号)试剂。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr +H2SO4反应,然后加入足量BaCl2溶液,经正确操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
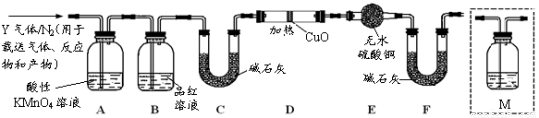
(3)装置B中试剂的作用是
(4)用化学方程式表示Y气体中的Q2气体是如何生成的 。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)金属铜具有良好的导电性和导热性,在电气和电子工业中应用广泛。请回答下列问题:
(1)资料显示:加热条件下氨气能够还原CuO得到金属铜。某同学用装置I和Ⅱ制取纯净干燥的氨气,装置I中应选用试剂______(供选用的试剂有:NH4Cl固体、NH4HCO3固体),试剂a最好选用__________,其作用是_________________________________________;装置III吸收尾气,如何检验所得溶液中数目最多的阳离子(只回答试剂名称和实验现象)_____________________。

(2)电解硫酸铜溶液也可得到金属铜。
①以黄铜矿(主要成份为CuFeS2)为原料采用电解法可制取硫酸铜溶液。实验室用如图所示装置模拟其过程,阳极区稀硫酸的作用是溶解矿粉得到Cu2+、Fe2+、H2S,硫酸铁的作用是氧化吸收H2S,防止逸出造成污染。电解过程中,阳极区Fe3+的浓度基本保持不变,原因是(用电极反应式回答)______________,阴极上先有固体析出,然后又溶解,阴极区通入O2的作用是(用离子方程式回答)__________________。

②用惰性电极电解一定浓度CuSO4溶液制取金属铜,一段时间后停止通电,此时加入9.8gCu(OH)2恰好能使电解质溶液恢复至初始状态,则该过程中阳极产生气体的体积为____________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
C、N、S是重要的非金属元素,下列说法正确的是
A.实验室用铜和浓硝酸反应制取NO
B.三种元素均可以和氧元素形成多种氧化物
C.CO2、SO2、NO2都能与H2O反应,且原理相同
D.稀硫酸、稀硝酸与铁的反应均属于置换反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:实验题
(14分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:下图是实验室制备PCl3的装置(部分仪器已省略)
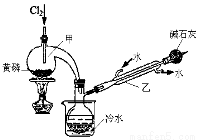
(1)仪器乙的名称 。
(2)实验室以制备Cl2的离子方程式: 。
(3)碱石灰的作用是 , 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是 。
(二)提纯:
(5)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示、不必化简)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
化学与社会、生产、生活紧切相关。下列说法正确的是
A.为了增加食物的营养成分,可以大量使用食品添加剂
B.高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用
C.石英只能用于生产光导纤维
D.从海水中提取物质都必须通过化学反应才能实现
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是
A.N2的电子式: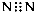
B.CH4的比例模型:
C.中子数为45的溴原子:45 35Br
D.对羟基苯甲酸的结构简式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com