
下列有关实验原理、操作或现象不正确的是( )
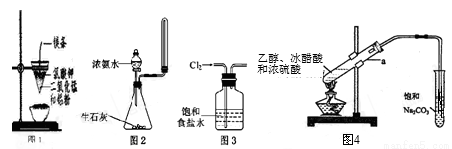
A.图1装置可制得金属锰,用同样的装置可制得金属铬
B.实验室用图2所示装置制取少量氨气
C.实验室用图3所示装置除去Cl2中的少量HCl
D.实验室用图4所示装置制乙酸乙酯
科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:选择题
根据表中短周期元素性质的数据判断,下列说法一定错误的是
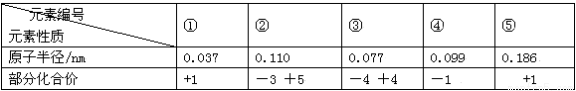
A.④是周期表中非金属性最强的元素
B.①是周期表中原子半径最小的元素
C.②④⑤在位于同一个周期
D.①③两元素组成的化合物分子与③④两元素组成的化合物分子空间构型相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:填空题
下列烷烃的名称是否正确?若不正确请改正。
(1)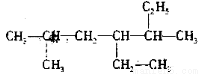 2-甲基-4,5-二乙基己烷__________________
2-甲基-4,5-二乙基己烷__________________
(2)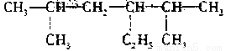 2,5-二甲基-4-乙基己烷________________
2,5-二甲基-4-乙基己烷________________
(3)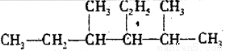 3-乙基-2,4-二甲基己烷_________________
3-乙基-2,4-二甲基己烷_________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
有A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B的最简式相同
D.A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:填空题
按要求填空:
(1)航天技术上使用的氢氧燃料电池具有高能、轻便、不污染环境等优点,碱式氢氧燃料电池中的电解质是碱,其正极反应表示为:O2+2H2O+4e- 4OH-,则其负极反应可表示为__________________。
4OH-,则其负极反应可表示为__________________。
(2)在一定条件下,RO3n-和I-发生反应的离子方程式如下: RO3n-+6I-+6H+=R-+3I2+3H2O
则R元素的原子最外层电子有 个。
(3)Na2SX在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
(4)CH4和H2O(g)通入聚焦太阳能反应器中,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器中,某温度下反应达到平衡时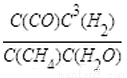 =27,此时测得n(CO)=0.2mol,则平衡时CH4的转化率为 .(计算结果保留三位有效数字)。
=27,此时测得n(CO)=0.2mol,则平衡时CH4的转化率为 .(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
向10 mL 0.1mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是:( )
A.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
B.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)<c(Al3+)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法中不正确的是( )
A.光导纤维遇强碱会“断路”
B.福岛核电站泄露的放射性物质l31I和127I互为同位素,化学性质几乎相同
C.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因
D.氢氧化铁溶胶、甘油与乙醇的混合液、含PM2.5的大气均具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:填空题
化学平衡原理是中学化学学习的重要内容,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气(主要成分CO、H2)制备甲醇。
(1)己知:CO、H2、CH3OH、的燃烧热(△H)分别为-283.0kJ/mol、-241.8kJ/mol、-192.2 kJ/mol,请写出合成气制备甲醇的热化学方程式 。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
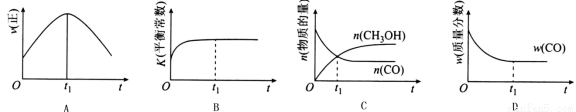
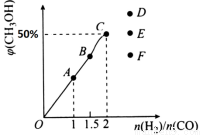
(3)在T1℃时,在体积为5 L的恒容容器中充入3 mol的合成气,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。H2和CO按2:1投入时经过5 min达到平衡,则5 min内用H2表示的反应速率为v(H2)=_______。温度不变,当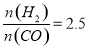 时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
(4)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:________________________。
(5)水的自偶电离可表示为H2O+H2O H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO32-)+c(CO32-)<0.1 mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO32- )>c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com