
某烷烃主链为4个碳原子的同分异构体有2种,则含相同碳原子数、主链也为4个碳原子的烯烃同分异构体有()种.
A. 4 B. 3 C. 5 D. 2
考点: 有机化合物的异构现象.
专题: 同分异构体的类型及其判定.
分析: 根据题干信息“烷烃主链为4个碳原子的同分异构体有2种”确定该烷烃的分子式,然后再根据官能团位置异构确定该烯烃的同分异构体数目.
解答: 解:首先:确定该烷烃碳原子个数:①主链为4个碳原子的烷烃,其支链只能是甲基(不可能是乙基,否则主链超过4个碳原子);②主链为4个碳原子的烷烃,支链数最多4个(下面的0,是指该物质只有一种,没有同分异构体),则:
支链含有的甲基为2个时,存在烷烃的同分异构体数目为2,所以该烷烃总共有6个碳原子,含有2个甲基,
其次:分析烯烃的同分异构体数目
①若双键在1号位,有以下3种烯烃的同分异构体:
C=C﹣C﹣C
1 2 3 4
2﹣乙基丁烯、2,3﹣二甲基丁烯、3,3﹣二甲基丁烯
②若双键在2号位,则只有一种该烯烃的同分异构体:
C﹣C=C﹣C
1 2 3 4
2,3﹣二甲基﹣2﹣丁烯
所以满足条件的该烯烃的同分异构体共有4种,
故选A.
点评:  本题主要考查了同分异构体的求算,题目难度中等,注意掌握同分异构体的概念及求算方法,要求学生熟练书写1﹣6个碳的碳链异构;常规的书写方法:碳链异构→位置异构→类别异构.
本题主要考查了同分异构体的求算,题目难度中等,注意掌握同分异构体的概念及求算方法,要求学生熟练书写1﹣6个碳的碳链异构;常规的书写方法:碳链异构→位置异构→类别异构.


科目:高中化学 来源: 题型:
下列有关氧化还原反应的说法正确的是( )
A.浓盐酸在化学反应中既可以作氧化剂,又可以作还原剂
B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C.在任何条件下都不能发生反应:Cu + H2SO4====CuSO4+ H2↑
D.亚氯酸可发生分解反应:HClO2→ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知,单质碘受热易升华.从海带中提取碘的实验过程中,涉及下列实验操作步骤,关于各步骤的实验目的或实验操作,描述正确的是( )
|
| A. |
将海带灼烧成灰 | B. |
过滤得含I﹣的溶液 |
|
| C. |
下层放出碘的苯溶液 | D. |
分离碘并回收苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL 1.00mol•L﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol•L﹣1 Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL,1.00mol•L﹣1盐酸恰好完全中和.
求:
(1)n(CO2)= mol;
(2)m(Na2SO4)= g;
(3)m(NaHCO3)= g.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是()
A. 1mol CH2=CH2可以与Br2发生加成反应,消耗1 mol Br2
B. 苯的邻位二元取代物只有一种,可以说明苯分子不具有碳碳单键和碳碳双键的交替结构
C. 甲苯中所有原子都在同一平面内
D. 苯乙烯(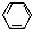 ﹣CH=CH2)与立方烷(
﹣CH=CH2)与立方烷( )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
出下列反应化学方程式,并写出该反应属于何反应类型.
(1)乙烯使溴水退色 ;
(2)苯与浓硫酸和浓硝酸的混合液共热 ;
(3)由乙炔制聚氯乙烯 ;
(4)乙烷与Cl2在光照条件下1:1反应:
(5)3﹣甲基﹣1﹣丁炔与溴的四氯化碳溶液按物质的量为1:1反应:
(6)用甲苯制2,4,6﹣三溴甲苯:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是()
选项 实验操作 实验现象 结论
A 向鸡蛋白溶液中滴入HgCl2溶液 有白色沉淀 蛋白质发生盐析
B 向溶液X中滴加BaCl2溶液 有白色沉淀 X中一定含有SO42﹣
C AgCl饱和溶液中加入少量NaI溶液 产生黄色沉淀 Ksp(AgI)>Ksp(AgCl)
D 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 红色逐渐退去 Na2CO3溶液中存在水解平衡
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)将燃烧黄铁矿的化学方程式补充完整
4________+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是__________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。计算:该铵盐中氮元素的质量分数是___________%;若铵盐质量为15.00 g,浓硫酸增加的质量为___________。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com