
����Ŀ��ij��Һ�п��ܺ���H+��Fe2+��Mg2+��Cu2+��NH4+��A13+��OH-��SO42- �е�һ�ֻ��֡�������һ�ֵ���ɫ���岢������Һʱ���д̼�����ζ������ų��Ͱ�ɫ�������������뵭��ɫ��������ʵ���(������)�����������Ͳ�����������ʵ���(������)�Ĺ�ϵ����ͼ��ʾ������д���пհ�:
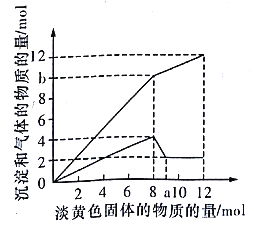
��1��ͼ��a���ֵ��__________�����ӵĵ���ɫ������_________ (�ѧʽ)��
��2������Һ�к��е�������_________��
��3����μ�����Һ�д��ڵ�������? _________��
���𰸡� 9 Na2O2 Mg2+��Al3+��NH4+��SO42- �ȼ�ϡ�������������������ټ��Ȼ�����Һ���а�ɫ��������
������������ɫ���������Һ�У���������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ���ɫ����ΪNa2O2��ͼ��ʵ��Ϊ����ͼ����һ�𣬽��ϵ������壬���µ��dz�����ͼ���м���8mol�������ƺ�ɫ������С����û����ȫ�ܽ⣬����Һ��һ��û��Fe2+��Cu2+��һ����NH4+��Al3+��Mg2+����Һ�б�����������ӣ�ֻ����SO42-������8mol��������֮�����������С��˵������8mol��������ʱ��笠�������ȫ��Ӧ��ֻ�ų�������
(1)���������֪��n(Mg2+)=n[Mg(OH)2]=2mol��n(Al3+)=4mol-n[Mg(OH)2]=2mol����2mol���������ܽ�ֻ��Ҫ2mol�������ƣ���1mol�������ƣ����a=9��������������֪������ɫ����Ϊ��Na2O2���ʴ�Ϊ��9��Na2O2��
(2)����������������Һ�к��е�������Mg2+��Al3+��NH4+��SO42-���ʴ�Ϊ��Mg2+��Al3+��NH4+��SO42-��
(3)������������ӿ�������Һ���ȼ�ϡ���ᣬ�����������ټ��Ȼ�����Һ���а�ɫ�����������ʴ�Ϊ���ȼ�ϡ���ᣬ�����������ټ��Ȼ�����Һ���а�ɫ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Ӧ��2A��g��B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A��g����20sʱ��ø���ֵ����ʵ������±�������˵����ȷ���ǣ� ��
���� | A��g�� | B��g�� | C��g�� |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
A.��Ӧǰ20 s�ڵ�ƽ����Ӧ����Ϊv��A��=0.6 molL��1s��1
B.20 sʱ������Ӧ���ʴ����淴Ӧ����
C.�ﵽƽ��ʱ��A��g����ת����Ϊ100%
D.�������¶�ƽ�ⳣ����Ϊ2����Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��һ�ֹ��ɽ�������۳�������ɫ�����ִ���ҵ�ж��ڵ���������в���ĥ��ĵ�λ���ִ���п�ķ����ɷ�Ϊ��ʪ�������࣮����Ǧ������п�ĸ���Ʒ��
��1������п�ǽ���п����Ҫ��ZnS��ͨ����ѡ������ʹ��ת��Ϊ����п���ٰ�����п�ͽ�̿��ϣ��ڹķ�¯�м�����1473��1573K��ʹп�������������п����ʹ��ת��Ϊ����п����Ҫ��ѧ��Ӧ����ʽΪ ��
��2��ij��п�����Ҫ�ɷ�ΪZnS����������FeS�������ɷ֣�������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ�� 
�ش��������⣺
�ٱ��չ����в����ĺ��������ɾ������ᣬ��������ں�����������
�ڽ���Һ�������������м������Ҫ����Ϊп�ۣ��������� ��
�۸Ľ���пұ�����գ������ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���й�ҵ��ֵ�ķǽ������ʣ�����ѹ������з�������Ҫ��Ӧ�����ӷ���ʽΪ
��3����ҵұ��п�Ĺ����У������Ǧ��������Ҫ�ɷ���PbO��Pb������������Ag��Zn��CaO��������������������ʣ���ij����С���о�����Ǧ������������Ǧ���������£� 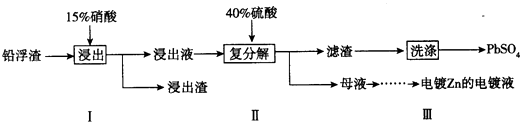
��֪��25��ʱ��Ksp��CaSO4��=4.9��10��5 �� KSP��PbSO4��=1.6��10��8 ��
����֪�������NO�������������Һ�к���������������Pb2+ �� д��Pb�μӷ�Ӧ�Ļ�ѧ����ʽ
�ڲ���������Pb��������ʹPb����ʣ�࣬Ŀ���� �� ��ƷPbSO4������Pb��NO3��2��Һ���ϴ�ӣ�Ŀ���� ��
��ĸҺ�п�ѭ�����õ����ʵĻ�ѧʽ������һ�����ʣ���ĸҺ���������ɵõ��Znʱ�������Һ���������϶�пʱ����������Ϊ ��
��4����п�����һ�ֳ�����أ���ص��ܷ�ӦʽΪ��Ag2O+Zn+H2O=2Ag+Zn��OH��2 �� �������ҺΪKOH��Һ����ع���ʱ�����ĵ缫ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2mol CO2��3mol H2 �� �����ķ�ӦΪCO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��akJmol��1��a��0�������CO2��g����CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
����˵���÷�Ӧ�Ѵ�ƽ��״̬���������ţ���
A����λʱ����ÿ����1.2mol H2 �� ͬʱ����0.4mol H2O
B��CO2����������ڻ�������б��ֲ���
C����������ƽ����Է�����������ʱ��ı仯���仯
D������ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ���
����ҪʹK=1����ı����������������ѡ���
A������ѹǿ B����Сѹǿ C�������¶� D�������¶� E�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ΪA��ij������Rn��,������X�����ӣ������������Ϊ
A��A-x B��A-x-n C��A-x+n D��A+x-n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol/L CH3COOH��Һ��HCN��Һ��pH�ֱ�Ϊm��n��1��m��n�������������в���ȷ���ǣ� ��
A.�����£�pH��ͬ��CH3COOH��Һ��HCN��Һ�ֱ��ˮϡ����ͬ�ı���ʱ��ǰ��pH�仯С
B.�����£���Ũ�ȵ�CH3COONa��NaCN��ҺpH�����ߴ�
C.HCN��Һ��NaOH��Һ���������Ϻ�һ������C��H+����C��OH����=C��CN������C��Na+��
D.��Һ����ˮ�������c��H+����ǰ���Ǻ��ߵ�10m��n��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����pH=5��H2SO4��Һϡ��1000������Һ��SO42������Ũ����H+����Ũ�ȵı�ֵԼΪ�� ��
A.1��10
B.1��1
C.1��2
D.1��20
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com