
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.反应5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4LN2时转移的电子数为3.75NA
B.1 mol浓硫酸与足量Mg完全反应,转移电子数可能为NA
C.标准状况下甲烷(CH4)和氧气(氧气充足)的混合气体共22.4L,完全燃烧后产物的分子总数一定为NA
D.10g的D2O中含有的质子数与中子数分别为5NA和4NA
【答案】C
【解析】
A. 此反应转移15mol电子时生成4mol氮气,若生成标况下22.4LN2,即1mol氮气时,转移的电子的物质的量为3.75mol,由于题目没有指明温度和压强,无法计算出氮气的物质的量,故无法计算转移的电子数,故A错误;
B.镁和浓硫酸反应生成硫酸镁、二氧化硫和水:Mg+2H2SO4![]() MgSO4+2H2O+SO2↑,此反应中2mol浓硫酸转移2mol电子,故若1mol浓硫酸全部发此反应,则转移1mol电子;镁和稀硫酸反应Mg+H2SO4=MgSO4+H2↑,此反应中,1mol硫酸转移2mol电子,而将足量镁投入到1mol浓硫酸中,镁先和浓硫酸反应后和稀硫酸反应,故转移的电子数介于NA到2NA之间,不可能是NA个,故B错误;
MgSO4+2H2O+SO2↑,此反应中2mol浓硫酸转移2mol电子,故若1mol浓硫酸全部发此反应,则转移1mol电子;镁和稀硫酸反应Mg+H2SO4=MgSO4+H2↑,此反应中,1mol硫酸转移2mol电子,而将足量镁投入到1mol浓硫酸中,镁先和浓硫酸反应后和稀硫酸反应,故转移的电子数介于NA到2NA之间,不可能是NA个,故B错误;
C.甲烷完全燃烧的化学方程式为CH4+2O2![]() CO2+2H2O,反应前后气体的分子数不变,条件为标准状态,因此1mol此混合气体燃烧后产物分子总数为NA,故C正确;
CO2+2H2O,反应前后气体的分子数不变,条件为标准状态,因此1mol此混合气体燃烧后产物分子总数为NA,故C正确;
D. 10gD2O物质的量=![]() =0.5mol,0.5mol分子中含有的质子数与中子数均为5NA,故D错误;
=0.5mol,0.5mol分子中含有的质子数与中子数均为5NA,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )

A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药托瑞米芬的前体K的合成路线如下。

已知:
ⅰ. 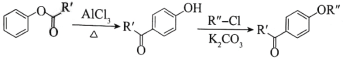
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]()
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是___________,反应类型是___________________________。
(2)D中含有的官能团:__________________。
(3)E的结构简式为__________________。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为__________________。
(5)M是J的同分异构体,符合下列条件的M的结构简式是__________________。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1 mol M最多消耗2 mol NaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是__________________。
(7)由K合成托瑞米芬的过程:
![]()
托瑞米芬具有反式结构,其结构简式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
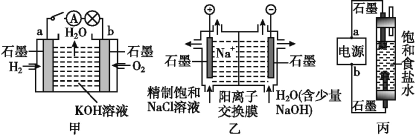
(1)甲装置中,a电极的反应式为_______________________________________。
(2)乙装置中,阴极区产物为________和_______。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_______(填“正”或“负”)极,该装置内,发生的电解方程式为___________________________________、生成消毒液的方程式为________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为___________(不考虑气体的溶解)。
(5)某工厂采用电解法处理含Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为Cr3+,Cr3+在阴极区生成Cr(OH)3沉淀除去,工作原理如图:
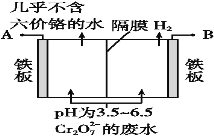
①写出电解时阳极的电极反应式:______________________________________。
②写出Cr2O72-被还原为Cr3+的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表一个恒温容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计),其中能表示氢气和氦气在容器中的相对关系的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
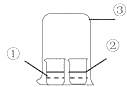
①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。

(1)装置A的名称是________,装置B中盛放的药品是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是______________,
发生主要反应的离子方程式为_________。FeSO4溶液要现用现配制的原因是_______,检验久置的FeSO4是否变质的方法是_________________。
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为________,取干燥后的FeCO3样品12.49 g,与炭混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com