
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、标准状况下,等体积的CH4和CO2所含共用电子对数相等 |
| B、与NaOH溶液、H2SO4溶液反应产生等量H2,所需铝粉质量相等 |
| C、1 mol OH-和17 g NH3所含电子数相等 |
| D、明矾溶液中K+和Al3+物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)如图1,X和Y均为石墨电极:
(Ⅰ)如图1,X和Y均为石墨电极:| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
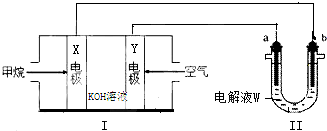
查看答案和解析>>
科目:高中化学 来源: 题型:
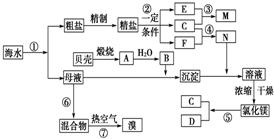
查看答案和解析>>
科目:高中化学 来源: 题型:

| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO | 2mol NO 2mol CO2 | 1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol?L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2CH3CH2OH(l)+6O2(g)═4CO2(g)+6H2O(l)△H=-1367 kJ/mol,可见乙醇燃烧热△H=-1367 kJ/mol |
| B、放热反应的反应速率总是大于吸热反应的反应速率 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、水的电子式: |
B、氯化钠的电子式: |
| C、KClO3的电离方程式:KClO3=K++Cl-+3O2- |
| D、碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com