
下列离子半径比大于1的是( )
A.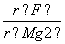 B.
B. C.
C.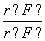 D.
D.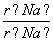
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l)
ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)
ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为_____________________________________________________________________________。
(2)反应②中的能量变化如图所示,则ΔH2=________。
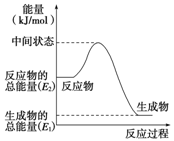
(3)H2(g)的燃烧热为________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:
__________________________________________________
__________________________________________________(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
钠的还原性比钾的弱,但工业上制取钾却用钠置换钾的原因是_________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,根据碱金属元素性质的递变规律预测其性质,其中不正确的是( )
A.在碱金属元素中它具有最大的原子半径
B.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
C.它的氢氧化物的化学式为FrOH,这是一种极强的碱
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示式错误的是( )
A.Na+的轨道表示式: B.Na+的结构示意图:
B.Na+的结构示意图: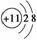
C.Na的电子排布式:1s22s22p63s1 D.Na的简化电子排布式:[Ne]3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y为同周期元素,且第一电离能X<Y,下列说法中正确的是( )
A.电负性:X<Y B.周期表中,X可能在Y的右边
C.若X与Y形成化合物,则X显正价,Y显负价 D.气态氢化物的稳定性:HmY强于HnX
查看答案和解析>>
科目:高中化学 来源: 题型:
据下列叙述,写出元素名称和核外电子排布式。
(1)A元素原子核外M层电子数是L层电子数的一半:___________。
(2)B元素原子的最外层电子数是次外层电子数的1.5倍:________________。
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃:________________________________________。
(4)D元素的次外层电子数是最外层电子数的1/4:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
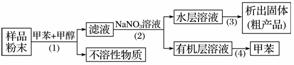
下列说法错误的是( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
已知a是H,b是N,c是O,d是S,a与其他元素形成的二元共价化合物中,分子中既含有极性共价键,又含有非极性共价键的化合物是________________________________(填化学式,写出两种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com