
【题目】氯化钾溶液常用作利尿剂及防治缺钾症的药物,某医疗实验小组需要用到480 mL物质的量浓度为0.5 mol·L-1的氯化钾溶液。回答下列问题:
(1)配制该溶液,需称量氯化钾晶体的质量是________。
(2)配制上述氯化钾溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、________、________。
(3)如图Ⅰ表示10 mL量筒中液面的位置,刻度A与B,B与C间均相差1 mL,如果刻度A为9,则量筒中液体的体积是________mL。

(4)定容时,某同学操作示意图如图Ⅱ所示,则其所配氯化钾溶液的浓度________(填“大于”“等于”或“小于”)0.5 mol·L-1;某同学由于操作不慎,定容时导致液面高于刻度线,他立即用胶头滴管将液体吸出,使液面恰好达到刻度线,请你评价该同学的做法:__________。
【答案】 18.6 g 胶头滴管 500 mL容量瓶 8.2 大于 该同学的做法错误,这样会导致配制的溶液浓度偏低
【解析】(1)配制480mL氯化钾溶液,需要500mL容量瓶,则配制该溶液,需称量氯化钾晶体的质量是0.5L×0.5mol/L×74.5g/mol≈18.6g。(2)配制上述氯化钾溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、胶头滴管、500 mL容量瓶。(3)量筒中刻度自上而下增大,刻度A与B,B与C间均相差1 mL,这说明相邻刻度线之间的是0.2mL,所以量筒中液体的体积是8.2mL;(4)定容时,某同学操作示意图如图Ⅱ所示,即定容时俯视,所以溶液的体积减少,则其所配氯化钾溶液的浓度大于0.5 mol·L-1;用胶头滴管将液体吸出,吸出的溶液中含有溶质,导致溶质的物质的量减少,溶液浓度偏低,所以这种做法是错误的。


科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
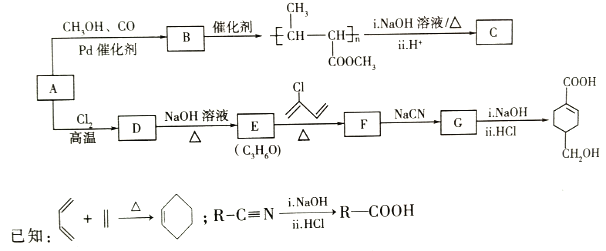
回答下列问题:
(1)D的名称是_______,B含有的含氧官能团的名称是_______________。
(2)C的结构简式为_______________,D→E的反应类型为________________。
(3)E→F的化学方程式为____________________________。
(4)![]() 中最多有__________个原子共平面,
中最多有__________个原子共平面,![]() 发生缩聚反应生成有机物的结构简式为_______________。
发生缩聚反应生成有机物的结构简式为_______________。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是__________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线。(无机试剂任选,合成路线流程图示例见本题题干) ________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工领域具有重要的应用价值,可采用硼砂、SiO2、Na和H2作为原料制备。回答下列问题:
(1)周期表中,与B的化学性质最相似的邻族元素是____;该元素基态原子核外M层电子中自旋状态相同的有_____个。
(2)NaBH4中,电负性最大的元素是____(填元素符号);B的____杂化轨道与H的1s轨道形成![]() 键。
键。
(3)硼砂是含8个结晶水的四硼酸钠。其阴离子(含B、O、H三种元素)的球模型如图所示:
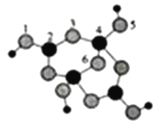
①阴离子中,配位键存在于____和____原子之间。(均填原子的序号)
②硼砂的化学式为_______。
(4)SiO2晶胞(立方体)如图所示,已知SiO2的密度为![]() g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
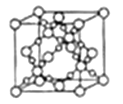
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用以下装置完成下列实验(图中a、b、c、d 为止水夹)。
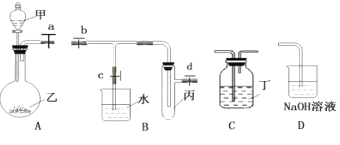
(1)仪器乙的名称_________。
(2)装置 A、B、D 相连,可证明SO2在水中的溶解度,相关操作依次是:制取 SO2,收集 SO2, 关闭止水夹 b、d,打开止水夹 c,_____________,
(3)若烧杯中有大量水倒吸入丙试管中,说明 SO2 易溶于水。 装置 A、C 相连,可用于证明C、Si 的非金属性强弱,则试剂甲是_____________,C 中 的 现 象 是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黑色物质甲只含两种元素,为探究物质甲的组成和性质,设计并完成如下实验。其中气态氢化物乙在标况下的密度为 1.518 g·L-1,甲和乙中相同元素的化合价相同。
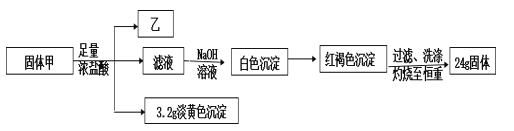
(1)甲的组成元素_____________。
(2)写出甲与足量浓盐酸反应的离子方程式______________。
(3)气体乙在过量空气中充分燃烧后,再将混合气体通入BaCl2溶液,出现白色沉淀。写出该过程中总反应的离子方程式_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为____。
(2)“滤渣Ⅰ”的主要成分为___(填化学式),该物质在工业上的用途为___(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为__。
(4)“氨解”的目的为___。“净化”时通入H2S的目的是___。
(5)“氧化”时发生反应的离子方程式为___。
(6)“系列操作”具体是指____、过滤、洗涤、干燥。若所得NiSO4·7H2O晶体不纯,应继续进行的提纯操作名称为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图1装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
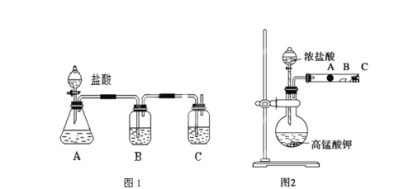
(1)根据实验图1作答:
①写出选用试剂分别 B__________,C____________
②装置B中所盛试剂的作用为_________
③C中反应的离子方程式为_______
④从实验所得非金属性C____Si(填“大于”或“小于”)
(2)根据实验图2作答:
①写出 A处的离子方程式:_______
②B处的现象_____
③C处药品的作用 _______。
④通过图2 装置实验得出同主族元素性质的递变规律为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。下列说法不正确的是
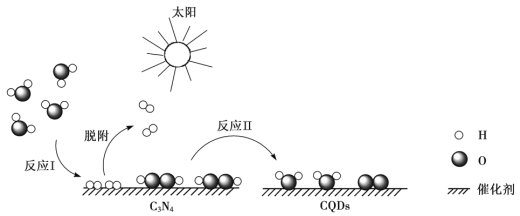
A. 通过该催化反应,实现了太阳能向化学能的转化
B. 反应I中涉及到非极性键的断裂和极性键的形成
C. 反应II为:2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
D. 总反应为:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com