
 .
.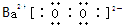 .
.分析 (1)钙原子核内有20个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,第三层上有8个电子,最外层上有2个电子;
(2)①金属键越强,熔点越高;②镁的活泼性强于铍,金属镁在高温下还原氟化铍制得铍单质;③铍酸化学式为H2BeO3,Be的化合价为+2价,氢氧化铍溶于氢氧化钠溶液生成Na2BeO2和水,据此书写离子反应方程式;
(3)Ba在充足的空气中燃烧可以生成过氧化钡,过氧化钡中钡离子和过氧根离子之间存在离子键、O原子之间存在共价键;
(4)氮化锂常温下与水反应生成氨和氢氧化锂,根据氮元素守恒计算.
解答 解:(1)在原子结构示意图中,圆圈表示原子核,圆圈内的数值为质子数,核外电子层用弧线表示,弧线上的数据表示每层的电子数,
钙原子核内有20个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有8个电子,其结构示意图为: ,
,
故答案为: ;
;
(2)①金属键越强,熔点越高,金属晶体中阳离子的电荷越多,半径越小,金属键越强,Mg、Be电荷相同,Be2+半径越小,所以金属键:Mg<Be,则熔点:Mg<Be,
故答案为:低;
②镁的活泼性强于铍,金属镁在高温下还原氟化铍制得铍单质,反应的化学方程式为:Mg+BeF2$\frac{\underline{\;高温\;}}{\;}$MgF2+Be,
故答案为:Mg+BeF2$\frac{\underline{\;高温\;}}{\;}$MgF2+Be;
③铍酸化学式为H2BeO3,Be的化合价为+2价,氢氧化铍溶于氢氧化钠溶液生成Na2BeO2和水,离子反应方程式为:Be(OH)2+2OH-=BeO22-+2H2O,
故答案为:Be(OH)2+2OH-=BeO22-+2H2O;
(3)Ba在充足的空气中燃烧可以生成过氧化钡,过氧化钡中钡离子和过氧根离子之间存在离子键、O原子之间存在共价键,电子式为: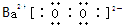 ,
,
故答案为: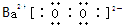 ;
;
(4)氮化锂常温下与水反应生成氨和氢氧化锂,其反应的方程式为Li3N+3H2O=3LiOH+NH3↑,
由氮元素和Li元素守恒:3Li~Li3N~NH3~$\frac{1}{2}$NH4NO3
3×7 $\frac{1}{2}$×80
2.1kg m
则m=$\frac{2.1kg×\frac{1}{2}×80}{3×7}$=4kg,
故答案为:Li3N+3H2O=3LiOH+NH3↑;4.
点评 本题考查了元素周期表和元素周期律综合应用,涉及原子结构、元素周期表的应用、方程式的书写、有关方程式的计算,题目难度中等,注意把握元素守恒在计算中应用.


科目:高中化学 来源: 题型:选择题
| A. | M>N | B. | M=10-4N | C. | N=10-4M | D. | M=N |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:填空题
在四个脱落标签的试剂瓶中,分别盛有盐酸、Ba(OH)2溶液、NaHCO3溶液、Mg(NO3)2溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为A+B混合产生无色气体;B+C混合产生白色沉淀;C+D混合产生白色沉淀;A+C混合无明显变化。
(1)A+C反应的离子方程式为 。
(2)A+B反应的离子方程式为 。
(3) C +D反应的离子方程式为 。
(4)少量B+C反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
下列物质的检验中,其结论一定正确的是( )
A.某溶液为蓝色,则该溶液一定是CuSO4溶液
B.向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl-
C.向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+
D.加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO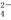
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 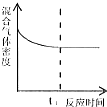 t1时刻表示该可逆反应达到新的平衡 | |
| B. |  横坐标x可表示温度或容器的体积 | |
| C. | 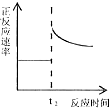 t2时刻改变的体积为加入少量的Y | |
| D. |  横坐标可表示为Z的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠的水解反应 CO32-+H2O→HCO3-+OH - | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-→3Fe3++2NO↑+4 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
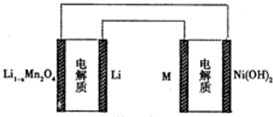 某充电宝锂离子电池的总反应为:xLi+Li1-nMn2O4$?_{充电}^{放电}$LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH$?_{充电}^{放电}$M+Ni(OH)2(M为储氢金属或合金),有关上述 两种电池的说法不正确的是
某充电宝锂离子电池的总反应为:xLi+Li1-nMn2O4$?_{充电}^{放电}$LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH$?_{充电}^{放电}$M+Ni(OH)2(M为储氢金属或合金),有关上述 两种电池的说法不正确的是| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-=Li1-nMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最简式为C2H4O的有机物一定可以发生银镜反应 | |
| B. | 不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 | |
| C. | 分子结构中含有4个甲基、碳原子数最少的烷烃的系统命名为:2,2-二甲基丙烷 | |
| D. | 甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com