
| A. | 导致易拉罐变瘪的离子反应是CO2+OH-=HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是Al3++3HCO3-=Al(OH)3+3CO2↑ | |
| C. | 上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性 | |
| D. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
分析 易拉罐变瘪发生CO2+2OH-═CO32-+H2O,气体的压强变小;过一会儿后,易拉罐又会作响并鼓起来,发生2Al+2OH-+2H2O═2AlO2-+3H2↑,气体压强增大,以此来解答.
解答 解:A.气体与碱反应,导致易拉罐变瘪,反应为CO2+2OH-═CO32-+H2O,故A错误;
B.易拉罐又会作响并鼓起来,发生2Al+2OH-+2H2O═2AlO2-+3H2↑,气体压强增大,故B错误;
C.上述过程共发生CO2+2OH-═CO32-+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O反应,反应后溶液显碱性,故C正确;
D.将CO2换为NH3,浓NaOH溶液换为水,只发生氨气与水反应,则易拉罐也会出现变瘪的现象,故D错误;
故选C.
点评 本题考查Al的化学性质及离子反应,为高频考点,明确发生的化学反应是解答本题的关键,题目难度不大,选项C为解答的难点,侧重分析与知识应用能力的考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等浓度的NaOH至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2moj/L的盐酸中加入等体积0.1mol/L氨水溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3••H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
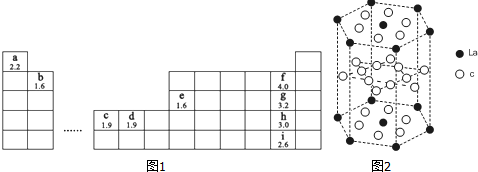
 .
.| 共价键 | f-f | g-g | h-h | i-i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 | |
| B. | Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | Na、K合金具有强还原性,可用于原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 冰箱中使用的含氟制冷剂泄漏后,会增加空气中PM 2.5的含量 | |
| C. | 氯气和活性炭均可作为漂白剂,同时使用可增强漂白效果 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 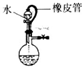 说明该装置气密性良好 | |
| B. | 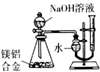 测定镁铝合金中铝的质量分数 | |
| C. | 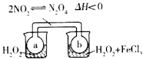 瓶中气体颜色变深,说明H202分解是吸热反应 | |
| D. | 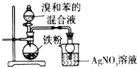 验证苯和溴发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5•H2O | Na2B4O7•10H2O | H3BO3 | NaBO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
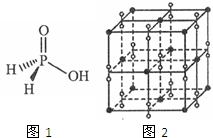 中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.
中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com