


科目:高中化学 来源: 题型:
A、F-的电子排布图: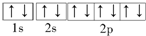 |
B、Na+的结构示意图: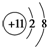 |
| C、Mg2+的电子排布式:1s22s22p6 |
| D、Cr的简化电子排布式:[Ar]3d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2D | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
 ,该氧化物的化学式为
,该氧化物的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
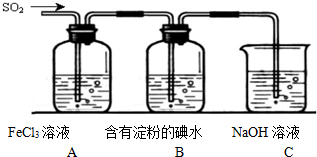
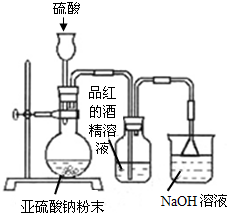 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
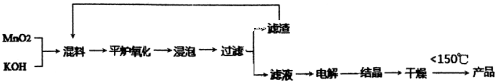
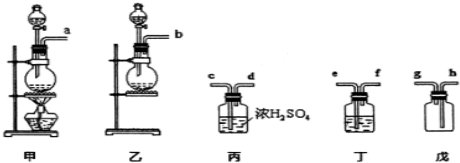
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,某溶液的pH<7,则该溶液呈酸性 |
| B、在水中加入少量碳酸钠固体将抑制水的电离 |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2 c(OH-)+c(CH3COO-) |
| D、浓度均为0.1mol/L的NH4Cl溶液和NH4HSO4溶液,前者的c(NH4+)大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )| A、若B点的横坐标a=12.5,且有c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a<b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH<8.0 |
| D、若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、木糖醇与葡萄糖、果糖等一样是一种单糖 |
| B、木糖醇极易溶于水 |
| C、木糖醇是一种五元醇 |
| D、木糖醇是一种无糖型植物甜味剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com