
| ��ѧ�� | C��H | C=C | C��C | H��H |
| ����/kJ��mol��1 | 414.4 | 615.3 | 347.4 | 435.3 |


 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 HCOONa+H2O�����й�˵����ȷ����
HCOONa+H2O�����й�˵����ȷ���� | A�����⡢������̾��������仯 | B����������У�NaHCO3������ |
| C��NaHCO3�������Ӽ����ۼ� | D����������У�ÿ����0.1molH2O�ų�2.24L��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HCl KCl | B��CO2 SiO2 | C��NH4Cl CCl4 | D��NaOH Na2O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ʯī�Ľṹ | B�����Ľṹ | C��CCl4�Ľṹ | D�������飨C8H8���Ľṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���٢ݢ� | C���� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2Na2O2+2H2O=4NaOH+O2�� |
| B��Mg3N2+6H2O=3Mg(OH)2��+2NH3�� |
C��Cl2+ 2NaOH NaClO+NaCl+H2O NaClO+NaCl+H2O |
| D��NH4Cl+NaOH= NaCl+NH3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
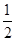 O2(g)=CO(g)����H����Q1kJ��mol��1��C(s)��O2(g)=CO2(g)����H����Q2 kJ��mol��1���й�������Ӧ������������ǣ� ��
O2(g)=CO(g)����H����Q1kJ��mol��1��C(s)��O2(g)=CO2(g)����H����Q2 kJ��mol��1���й�������Ӧ������������ǣ� ��| A��Q1��Q2 |
| B�������������������ڷ�Ӧ�������� |
| C����1 mol C��Ӧ����1 mol CO����ʱ�ų�Q1 kJ���� |
| D��1 mol CO2������е���������1 mol�ɱ����е����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HI | B��NaOH | C��Br2 | D��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ı�ȼ����Ϊ��H=-890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ CH4(g)+2O2(g)=CO2(g)+2H2O(g)��H=-890.3kJ��mol-1 |
| B����֪H2O(l)= H2O(g)��H="+44" kJ��mol-1�� ��2gH2(g)��ȫȼ������Һ̬ˮ��������̬ˮ���ͷ�22kJ������ |
| C�������£���ӦC(s)+CO2(g)=CO(g)�����Է�����,��÷�Ӧ�ġ�H ��O |
| D��ͬ��ͬѹ�£�H2(g)+ Cl2 (g)="2HCl" (g)�ڹ��պ͵�ȼ�����µġ�H��ͬ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com