
下列说法正确的是
A.乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底
B.把乙烯通入溴水中,溴水立即褪色,这是由于乙烯具有漂白性
C.煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化
D.苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)2.3.3化学平衡常数试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:选择题
下列各组物质按下图所示转化关系每一步都能一步实现的是

| 甲 | 乙 | 丙 | 丁 |
A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B | Cu | CuO | CuSO4 | CuCl2 |
C | NO | HNO3 | NO2 | NH3 |
D | Al(OH)3 | NaAlO2 | Al2O3 | AlCl3 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
部分氧化的Fe?Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
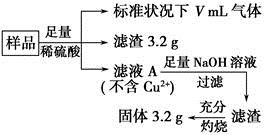
下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是
A.v(NH3)=v(O2) B.v(O2)=v(H2O)
C.v(NH3)=v(H2O) D.v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
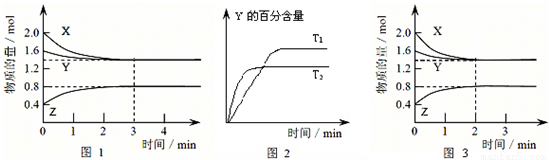 A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为3X(g)+Y(g)  2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。请写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2(或MgR2)型树脂置于______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,右面是海水利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:
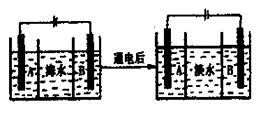
①阳离子交换膜是指________(填“A”或“B”)。
②写出通电后阳极区的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO、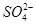 、
、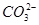 、
、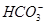 、
、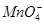 。
。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、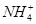 。
。
将该白色粉末进行下列实验,观察到的现象如下:
实验操作 | 现象 |
a.取少量粉末,加水、振荡 | 全部溶解、 |
溶液无色透明 |
|
b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
c.取少量粉末,加盐酸 | 无明显现象 |
d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有 (填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有 。
(3)从c实验中,可推断粉末中不可能有 。
(4)从d实验中,可推断粉末中不可能有 ,一定含有 。
(5)以上各实验仍无法确定是否存在的离子是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com