
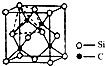
 (2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
(2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.

| 1 |
| 2 |
 ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(2013?乐山三模)下列各项中,理由、结论及因果关系均正确的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com