
已知X、Y、Z、W四种短周期主族元素在周表中的相对位置如图所示,下列说法正确的是 ( )
| X | Y |
| Z | W |
A.W的原子序数可能是Y的原子序数的2倍
B.Z元素的原子半径可能比Y元素的小
C.W的气态氢化物的稳定性一定 比Y的强
比Y的强
D.Z的化学活泼性一定比X强
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
溴及其化合物广泛用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下 :
:
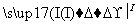
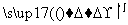
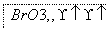
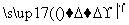
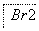
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是_______________________。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
 Br2+
Br2+ Na2CO3===
Na2CO3=== NaBrO3+
NaBrO3+ CO2+
CO2+ ________
________
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是__________是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
则原溶液中NaI的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊五种短周期元素原子序数依次递增。甲最
外层电子数是次外层的两倍,丙的次外层电子数比最外层少4个,丁形成的简单阳离子是同周期元素简单
离子中半径最小的,戊是同周期主族元素中原子半径最小的。试用化 学式回答下列问题:
学式回答下列问题:
(1)乙和戊形成的化合物中各原子最外层均满足8e-结构,其化学式为 ;
(2)写出乙的最高价氧化物的水化物的浓溶液与甲单质反应的化学方程式
;
(3)戊的最高价氧化物与丁的最高价氧化物的水化物反应的离子反应方程式为
;
(4) 常温下戊单质被NaOH溶液吸收的化学方程式为 ;
(5)氢与丙形成原子个数比为1:1的液体,该物质中存在的作用力有( )
①极性键 ②非极性键 ③离子键 ④氢键 ⑤范德华力
④氢键 ⑤范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
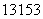 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中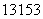 I的含量变化来监测核电站是否
I的含量变化来监测核电站是否
发生放射性物质泄漏。下列有关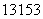 I的叙述中错误的是 ( )
I的叙述中错误的是 ( )
A. 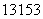 I的化学性质与
I的化学性质与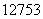 I相同
I相同
B. 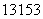 I的原子序数为53
I的原子序数为53
C. 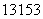 I的原子核外电子数为78
I的原子核外电子数为78
D. 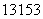 I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在周期表中的相对位置如图,W
原子的最外层电子数是其最内层电子数的3倍。下列判断正确的是
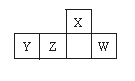 A.原子半径:X>Y>Z>W
A.原子半径:X>Y>Z>W
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.最简单气态氢化物的热稳定性:Z >W
D.X的氢化物能与其最高价氧化物对应的水化物反应生成盐
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学反应速率的认识正确的是
A.H+和OH—的反应活化能接近于零,反应几乎在瞬间完成
B.对于任何化学反应来说,反应速率越大,反应现象就越明显
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将一定量的冰醋酸(无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。

请完成下列问题:
(1)上述a、b、c三点对应醋酸的电离程度最大的是 (填“a”、“b”、“c”),三点对应溶液中c(OH-)由大到小的顺序为 。
(2)c点对应的溶液中c(H+)与c(CH3COO-)+c(OH-)的关系为前者 (填“大于”“小于”“等于”)后者。
(3)从a点到b点,溶液中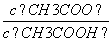 的比值 (填“增大”、“减小”、“等于”)。
的比值 (填“增大”、“减小”、“等于”)。
(4)25 ℃时,体积均为100 mL 、pH=m的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。则稀释前两溶液中c(OH-)= , HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。

(5)若用pH试纸进行实验,你能否区分上述HX和CH3COOH两种酸溶液?若能,请简述操作过程;若不能,请说明理由。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一块银白色 的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是 ( )
的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是 ( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com