
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
分析 A.双氧水溶液中,水分子中也含有氧原子;
B.根据放出热量计算出消耗氮气的物质的量,然后根据化合价变化计算出转移电子的数目;
C.缺少溶液体积,无法计算硫化钠的物质的量;
D.浓硝酸随着反应的进行,逐渐变为稀硝酸,铜与稀硝酸反应生成的是NO.
解答 解:A.34g质量分数为4%的H2O2水溶液中,双氧水的物质的量为:$\frac{34g×4%}{34g/mol}$=0.04mol,双氧水中含有0.08mol氧原子,由于溶剂水中也含有氧原子,则该溶液中含氧原子数目大于0.08NA,故A错误;
B.放出4.6kJ热量消耗氮气的物质的量为:$\frac{4.6kJ}{92kJ/mol}$=0.05mol,则转移电子的物质的量为:0.05mol×[0-(-3)]×2=0.3mol,则转移电子数目为0.3NA,故B正确;
C.没有告诉0.1mol•L-1Na2S溶液的体积,无法计算溶液中含有硫离子的数目,故C错误;
D.40mL10mol•L-1浓硝酸中含有硝酸的物质的量为0.4mol,6.4g铜的物质的量为0.1mol,0.1mol铜完全反应消耗浓硝酸0.4mol,而浓硝酸随着反应的进行,逐渐变为稀硝酸,故6.4 gCu不能完全反应生成NO2,还有部分生成NO,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度之间的关系为解答关键,C、D为易错点,注意C中缺少溶液体积,D中会生成部分NO气体,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 | |
| B. | 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 | |
| C. | 洗涤的操作是向过滤器里的固体加洗涤剂,使洗涤剂浸没固体,待洗涤剂自然流下 | |
| D. | 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| B. | 标准状况下,22.4L C2H4与C3H6混合气体所含有分子数为NA | |
| C. | 相同温度下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA | |
| D. | 18g NH42+所含的电子数11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
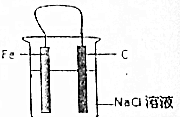 有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )
有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )| A. | 铁片为负极,碳棒为正极 | |
| B. | 铁被腐蚀,碳棒上有氯气放出 | |
| C. | 碳棒附近的溶液可使酚酞变红 | |
| D. | 导线上有电流通过,电流方向是由碳极流向铁极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Fe(SO4)2•12H2O | B. | NH4Al(SO4)2•12H2O | C. | (NH4)2Fe(SO4)2•6H2O | D. | (NH4)2Fe(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
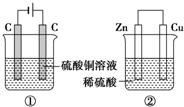 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com