
【题目】(1)质量之比为16∶7∶6的三种气体二氧化硫、一氧化碳、一氧化氮,分子数之比为________;氧原子数之比为________;相同条件下的体积之比为__________。
(2)标准状况下,1.7g氨气的体积是________,与其含有相同数目氢原子的硫化氢的体积是__________。
(3)某气体氧化物的化学式为RO2,标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_________,R的相对原子质量为__________。
【答案】5∶5∶4 10∶5∶4 5∶5∶4 2.24 L 3.36 L 64g/mol 32
【解析】
(1)根据n=![]() =
=![]() =
=![]() 计算;
计算;
(2)根据n=![]() =
=![]() =
=![]() 计算标况下氨气的体积,含有氢原子数目相同,说明二者含有氢原子的物质的量相等,据此计算出硫化氢的物质的量,然后根据V=nVm计算出标况下氯化氢的体积;
计算标况下氨气的体积,含有氢原子数目相同,说明二者含有氢原子的物质的量相等,据此计算出硫化氢的物质的量,然后根据V=nVm计算出标况下氯化氢的体积;
(3)根据n=![]() 计算出1.28g该氧化物的物质的量,然后根据M=
计算出1.28g该氧化物的物质的量,然后根据M=![]() 计算该氧化物的摩尔质量,从而可知该氧化物的相对分子量,结合分子组成计算出R的原子量;
计算该氧化物的摩尔质量,从而可知该氧化物的相对分子量,结合分子组成计算出R的原子量;
(1)SO2、CO、NO质量之比为16:7:6,则根据n=![]() ,可知SO2、CO、NO的物质的量之比n(SO2):n(CO):n(NO)=
,可知SO2、CO、NO的物质的量之比n(SO2):n(CO):n(NO)=![]() :
:![]() :
:![]() =5:5:4,由于n=
=5:5:4,由于n=![]() ,所以三种气体的分子数之比N(SO2):N(CO):N(NO)=5:5:4,根据物质分子中含有的O原子数关系可知,三种物质分子中所含氧原子数之比为10:5:4,结合n=
,所以三种气体的分子数之比N(SO2):N(CO):N(NO)=5:5:4,根据物质分子中含有的O原子数关系可知,三种物质分子中所含氧原子数之比为10:5:4,结合n=![]() ,可知在相同条件下三种气体的体积之比为5:5:4;
,可知在相同条件下三种气体的体积之比为5:5:4;
(2)1.7gNH3的物质的量n=![]() =0.1mol,其中标准状况下的体积V=n·Vm=0.1mol×22.4L/mol=2.24 L;
=0.1mol,其中标准状况下的体积V=n·Vm=0.1mol×22.4L/mol=2.24 L;
0.1mol NH3中含有0.3mol氢原子,与0.15mol H2S含有相同数目的氢原子,则H2S气体在标准状况下体积V=n·Vm=0.15mol×22.4 L/mol=3.36 L;
(3)标准状况下,1.28g该氧化物的体积为448 mL,其物质的量n=![]() =
=![]() =0.02 mol,该气体的摩尔质量M=
=0.02 mol,该气体的摩尔质量M=![]() =64g/mol,则气体的相对分子质量是64,R的相对原子质量为:64-16×2=32。
=64g/mol,则气体的相对分子质量是64,R的相对原子质量为:64-16×2=32。


科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
A.将11.2gFe粉投入到足量稀硫酸中,在标准状况下生成的气体分子数为0.3NA
B.500mL 0.2mol·L-1 CaCl2溶液中,Ca2+和Cl-离子总数为0.2NA
C.标准状况下,22.4 L SO3含有的分子数为NA
D.常温常压下,32 g O2和32 g O3含有的氧原子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下 ①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2 mol NH3,这四种气体的关系表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的( )

A.Pt为阴极,Cu为阳极
B.电解过程中CuSO4溶液的pH逐渐增大
C.b极的电极反应式是2H++2e-=H2↑
D.Cu极上有6.4gCu析出时,b极产生2.24L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为: H2+CO32——2e—![]() H2O+CO2。则下列判断中正确的是
H2O+CO2。则下列判断中正确的是
A.放电时CO32—向负极移动
B.放电时CO32—向正极移动
C.正极反应: 4OH——4e—=2H2O+O2↑
D.当电池中生成1 mol水时,转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | a | c | d | e | f | g | |
3 | b | h | i | j | k |
(1)这些元素中非金属性最强的单质是_________,最高价氧化物对应水化物酸性最强的是_________,最高价氧化物对应水化物碱性最强的是_________。
(2)表中k的氢化物的化学式为_____,它的还原性比j的氢化物还原性_______(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性_______(填“强”或“弱”)。
(3)e单质为________,其结构式为________________。
(4)用电子式表示h与k构成化合物的形成过程________________
(5)写出i的氧化物与强碱溶液反应的离子方程式________________
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是____(填写选项)。
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用下图所示装置进行实验。以探究苯与溴发生反应的原理并分离提纯反应的产物。
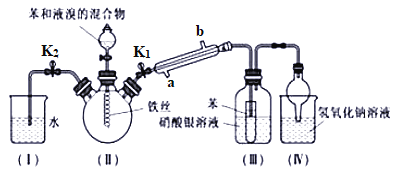
请回答下列问题:
(1)写出装置Ⅱ中发生的主要化学反应方程式____________________________,其中冷凝管所起的作用为导气和________,Ⅳ中球形干燥管的作用是__________。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。Ⅲ中小试管内苯的作用是_________________________。
(3)能说明苯与液溴发生了取代反应的现象是______________________。
(4)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中以除去装置Ⅱ中残余的HBr气体。简述如何实现这一操作:______________________________________。
(5)纯净的溴苯是无色油状的液体,这个装置制得的溴苯呈红棕色,原因是里面混有______________,将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。①用蒸馏水洗涤,振荡,分液;②用__________洗涤,振荡,分液;③蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学依照如下图所示流程提取海带中的碘元素。

(1)步骤①中灼烧海带所用的仪器是__________(填序号)。
a.试管 b.坩埚 c.烧杯
(2)步骤④中用硫酸酸化的H2O2溶液将I-氧化成I2,反应的离子方程式是__________________。
(3)步骤⑤中采用的分离方法是___________________。
(4)经步骤⑤得到含I2的CCl4溶液后,继续采取步骤⑥⑦的目的是_______________。
(5)步骤⑦的反应中,当1molIO3-发生反应时,转移电子的物质的量是__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com