
| A. | KI | B. | I2 | C. | I- | D. | KIO3 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿酸酸性比盐酸弱 | B. | 尿酸钠的溶解度随温度升高而增大 | ||
| C. | 反应①为吸热反应,②为放热反应 | D. | 尿酸钠的熔点很低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 101 kPa下,26 g乙炔在足量氧气中完全燃烧生成液态水,放出1 299.6 kJ的热量:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 299.6 kJ | |
| C. | 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| D. | 1 mol B2H6气体完全燃烧生成固态三氧化二硼和液态水,放出2 165 kJ的热量:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2 165 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致 | |
| B. | 钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| D. | 硅胶可用作食品干燥剂和催化剂载体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
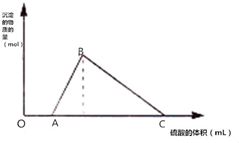 将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则
将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com