
| A、若为恒容容器,当a:b:c为2:2:1时,平衡不移动 | B、若为恒容容器,当a:b=9:10,且c=0时,达平衡后,A、B、C物质的量之比仍为2:2:1 | C、若为恒压容器,当a:b为9:10,c为任意值时,平衡后A的质量分数一定仍为w% | D、若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w% |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:阅读理解
| 时间/S | c(CO2)mol/L | c(H2)mol/L |
| 0 | 1.00×10-1 | 3.00×10-1 |
| 1 | 8.50×10-2 | 2.55×10-1 |
| 2 | 6.50×10-2 | 1.95×10-1 |
| 3 | 5.50×10-2 | 1.65×10-1 |
| 4 | 5.00×10-2 | 1.50×10-1 |
| 5 | 5.00×10-2 | 1.50×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
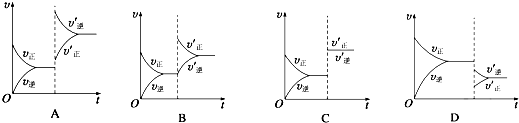
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在密闭容器中进行SO2的催化氧化反应。若起始时[SO2]=[O2]=6mol/L,平衡时测得[O2]=4.5mol/L,则下列叙述中正确的是( )
A.SO2的转化率为60%
B.SO3的产率为50%
C.平衡时总压强与起始压强之比为7∶8
D.平衡时VSO2∶VO2∶VSO3=3∶3∶1
查看答案和解析>>
科目:高中化学 来源:2010-2011学年西藏拉萨中学高三第七次月考(理综)化学部分 题型:选择题
某温度下,在密闭容器中存在下列可逆反应:A(g)+2B(g)  4
C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
4
C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
A.若为恒容容器,当a∶b∶c为2∶2∶1时,平衡不移动
B.若为恒容容器,当a∶b =9∶10,且c=0时,达平衡后,A、B、C物质的量之比仍为2∶2∶1
C.若为恒压容器,当a∶b为9∶10,c为任意值时,平衡后A的质量分数一定仍为w%
D.若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com