解:(1)最高正化合价和负化合价的绝对值相等,则最外层电子数为4,元素R位于周期表中的第三周期,所以R为硅元素,RO
2的是SiO
2,其用途有:制作光纤、饰品、建筑材料、石英玻璃、石英坩埚等,
故答案为:制作光纤、饰品、建筑材料、石英玻璃、石英坩埚等;
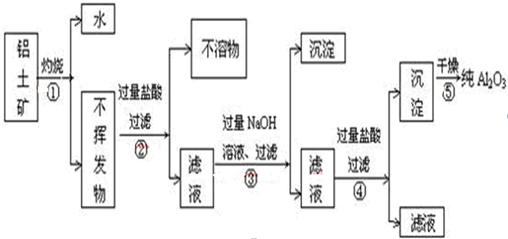
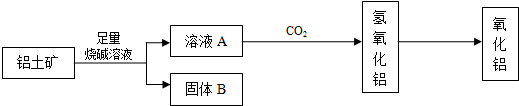
(2)铝土矿加入足量烧碱溶液,Al
2O
3、SiO
2与氢氧化钠反应,氧化铁不与氢氧化钠反应,
①氧化铝与氢氧化钠反应生成偏铝酸钠和水,反应离子方程式为Al
2O
3+2OH
-=2AlO
2-+H
2O;
②二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,离子方程式为SiO
2+2OH
-=SiO
32-+H
2O;
故答案为:Al
2O
3+2OH
-=2AlO
2-+H
2O;SiO
2+2OH
-=SiO
32-+H
2O;
(3)电解氧化铝和冰晶石的熔融液,生成铝和氧气,氧元素在阳极上被氧化,生成氧气,电极反应式为2O
2--4e
-=O
2↑,
故答案为:2O
2--4e
-=O
2↑;
(4)根据元素守恒可知X为碳的氧化物,由电子转移守恒,可得在X中C的化合价为

=2,所以X是CO,所以该反应的化学方程式为Al
2O
3+N
2+3C

2AlN+3CO,
故答案为:Al
2O
3+N
2+3C

2AlN+3CO.
分析:(1)最高正化合价和负化合价的绝对值相等,则最外层电子数为4,元素R位于周期表中的第三周期,所以R为硅元素;
(2)铝土矿加入足量烧碱溶液,Al
2O
3、SiO
2与氢氧化钠反应;
(3)阳极发生氧化反应,氧离子在阳极放电生成氧气;
(4)根据元素守恒可知X为碳的氧化物,由电子转移守恒,求出C在X中的化合价,判断出X,据此书写化学方程式.
点评:本题考查内容较多,涉及铝、铁、硅的化合物、电化学、氧化还原反应等,难度中等,(4)中关键根据守恒,判断出X的化学式.

 =2,所以X是CO,所以该反应的化学方程式为Al2O3+N2+3C
=2,所以X是CO,所以该反应的化学方程式为Al2O3+N2+3C 2AlN+3CO,
2AlN+3CO, 2AlN+3CO.
2AlN+3CO.