
| A. | 乙烷与Cl2取代 | B. | 乙烯与Cl2加成 | ||
| C. | 乙炔与HCl加成 | D. | 乙醇与浓盐酸取代 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 为了除去溴苯中的溴单质,用四氯化碳进行萃取、分液 | |
| B. | 乙烷与氯气物质的量之比1:1,光照可以制得纯净氯乙烷 | |
| C. | 将氯乙烷与氢氧化钠水溶液共热一段时间后,加入AgNO3溶液,产生沉淀,即证明氯乙烷中含有氯元素 | |
| D. | 为了除去乙烷中的乙烯气体,可将混合气体通过盛溴水的洗气瓶进行洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ①③⑥⑦ | C. | ②③④⑦ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的乙酸乙酯中含有18O | B. | 生成的水分子中不含18O | ||
| C. | 可能生成44g乙酸乙酯 | D. | 可能生成90g乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
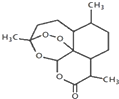 我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )
我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )| A. | 化学式为C15H20O5 | |
| B. | 只含有氧原子一种官能团 | |
| C. | 能发生取代反应和氧化反应 | |
| D. | 可用乙醇从青蒿浸取液中萃取出青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO32-)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应时构成分子的原子种类发生改变 | |
| B. | 分子、原子、离子都是构成物质的微粒 | |
| C. | 不同元素最本质的区别在是相对原子质量不同 | |
| D. | 原子不显电性,是因为原子中不存在带电的粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com