
【题目】下列溶液一定呈中性的是( )
A. pH=7的溶液 B. c(H+)=c(OH-)=10-6mol/L溶液
C. 使石蕊试液呈紫色的溶液 D. 酸与碱恰好完全反应生成正盐的溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硬脂酸甘油酯是天然高分子化合物
B.葡萄糖在酒化酶催化下,可以水解为乙醇,这是酿酒的原理
C.浓的硫酸钠溶液加入鸡蛋清中,蛋白质变性而凝聚
D.“离离原上草,一岁一枯荣”,小草富含纤维素,可以用来造纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与盐酸 ⑤Na与O2。由于条件不同而能发生不同氧化还原反应的是
A. 只有③④ B. 只有①② C. 只有①③⑤ D. 只有①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下表所示。X元素最常见价态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物。下列说法正确的是
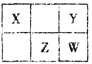
A. 简单离子半径:W>Z>Y
B. 简单气态氢化物的稳定性:Y >Z > W
C. 最高价氧化物对应的水化物酸性:W >Z
D. 若W的最高正价为+ m,则Y的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( )
A. KX、KZ、KY B. KX、 KY、KZ
C. KZ、KY 、KX D. KY、KZ、KX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接好装置(装置气密性良好),用小火均匀加热大试管A 5~10 min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置,待分层;④分离出乙酸乙酯层,洗涤、干燥。

已知:乙醇可以和氯化钙反应,生成微溶于水的CaCl2·6C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) |
| 338.0 | 1.84 |
(1)配制反应混合液的主要操作步骤为_______________________(不必指出液体体积);制取乙酸乙酯的化学方程式为________________。
(2)上述实验中饱和Na2CO3溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.减小乙酸乙酯的溶解度,有利于其分层析出
D.加速乙酸乙酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因之一是温度过高会发生副反应,另一个原因是________________________________________________________。
(4)写出步骤③中观察到的现象___________________________。
(5)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤。通过洗涤可除去的杂质是________(填名称);干燥乙酸乙酯可选用的干燥剂为________(填字母)。
A.P2O5 B.无水硫酸钠
C.碱石灰 D.NaOH固体
(6)某化学课外小组设计了图乙所示的制取乙酸乙酯的装置(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有________(填字母)。

a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液,减少反应物蒸发
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A型环氧树脂广泛应用于涂料、玻璃钢、包封等领域,可由下列路线合成制得(部分反应条件和产物略去):

已知:二酚基丙烷简称双酚A,双酚A型环氧树脂的结构简式为

回答下列问题:
(1)A含有的官能团结构简式为___________,C的化学名称为___________。
(2)A→B的反应类型为________,双酚A的核磁共振氢谱共有_____个吸收峰。
(3)分子中不含碳碳双键的D的同分异构体(不考虑立体异构)共有__________种。
(4)写出由D和双酚A合成双酚A型环氧树脂的化学方程式:____________________。
(5)参照双酚A型环氧树脂上述合成路线,设计一条由环戊二烯![]() 为起始原料制备
为起始原料制备![]() 的合成路线。__________
的合成路线。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
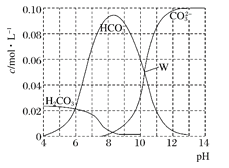
A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下发生下列反应: (1)16H+ +10Z-+ 2XO-4 ===2X2++ 5Z2+ 8H2O (2) 2A2十+B2==2A3++ 2B- (3) 2B- +Z2==B2+2Z- 根据上述反应,判断下列结论中错误的是( )
A. 溶液中可能发生:Z2+2A2+==2A3++2Z- B. Z2在①、③反应中均为氧化剂
C. 氧化性强弱顺序为:XO-4>Z2>B2>A3+ D. X2+是XO-4的还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com