
| 序号 | 符合的条件 | 序号 |
| 1 | 电解质 | |
| 2 | 非电解质 | |
| 3 | 强电解质 | |
| 4 | 弱电解质 | |
| 5 | 既不是电解质也不非电解质 | |
| 6 | 能导电的物质 |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
水溶液中能完全电离的电解质,为强电解质,能部分电离的为弱电解质;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
单质与混合物既不是电解质也不是非电解质;
物质导电的条件含有自由电子或者自由移动的离子.
解答 解:①铜,含有自由电子,能够导电;属于单质,既不是电解质,也不是非电解质;
②稀硫酸含有自由移动的离子,能导电;属于混合物,既不是电解质,也不是非电解质;
③氯化氢不含自由电子,也不含自由移动的离子,不导电;属于混合物,水溶液中能完全电离,属于电解质,属于强电解质;
④氨气不含自由电子,也不含自由移动的离子,不导电;属于化合物,本身不能电离产生自由移动的离子,属于非电解质;
⑤Na2CO3溶液含有自由移动的离子,能导电;属于混合物,既不是电解质,也不是非电解质;
⑥CO2不含自由电子,也不含自由移动的离子,不导电;属于化合物,本身不能电离产生自由移动的离子,属于非电解质;
⑦冰醋酸不含自由电子,也不含自由移动的离子,不导电;属于化合物,在水溶液中能部分电离产生自由移动的离子,属于电解质,属于弱电解质;
⑧NaCl不含自由电子,也不含自由移动的离子,不导电;水溶液或者熔融状态下能完全电离,属于电解质,属于强电解质;
⑨CaCO3不含自由电子,也不含自由移动的离子,不导电;熔融状态下能完全电离,属于电解质,属于强电解质;
⑩Cl2不含自由电子,也不含自由移动的离子,不导电;属于单质,既不是电解质,也不是非电解质;
故答案为:
| 序号 | 符合的条件 | 序号 |
| 1 | 电解质 | ③⑦⑧⑨ |
| 2 | 非电解质 | ④⑥ |
| 3 | 强电解质 | ③⑧⑨ |
| 4 | 弱电解质 | ⑦ |
| 5 | 既不是电解质也不非电解质 | ①②⑤⑩ |
| 6 | 能导电的物质 | ①②⑤ |
点评 本题考查了电解质、非电解质、强电解质、弱电解质的判断,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质,注意电解质必须是本身能电离的化合物,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 只根据反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,不能判断出该反应△H的正负 | |
| B. | 对于反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),加入更多的催化剂会使平衡向正反应方向移动 | |
| C. | 向纯水中加入盐酸能使水的电离平衡逆向移动,但水的离子积不变 | |
| D. | 用惰性电极电解1 L 1 mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 mol Cu(OH)2固体可将溶液恢复至原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通HCl(g) | B. | 加入少量KF(s) | C. | 加入少NaOH(s) | D. | 通入少量HF(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
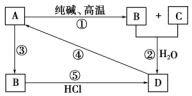 已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.
已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
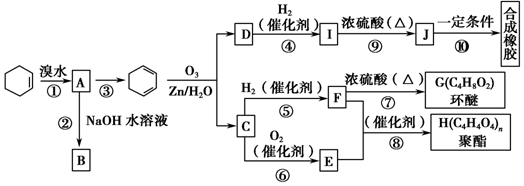
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com